Bei Reaktionen wie der Hofmannschen erschöpfenden Methylierungs-Eliminierungs-Reaktion wird im Allgemeinen das am wenigsten substituierte Olefin als Hauptprodukt gebildet. Dies wird als Hofmannsche Regel bezeichnet. Alle diese Reaktionen tragen geladene Abgangsgruppen wie -NR3+ oder -SR2+ und erfordern starke Basen. Die Zaitsev-Regel (oder Saytzeff-Regel) lenkt unsere Aufmerksamkeit auf eine andere Möglichkeit. Durch Eliminierung von HX erhält man das stabilere Olefin (Abb. 2.3.1). Der scheinbare Widerspruch in diesem Regelwerk lässt sich durch eine kritische Betrachtung der Mechanismen, die bei diesen beiden Reaktionsbedingungen ablaufen, leicht auflösen.
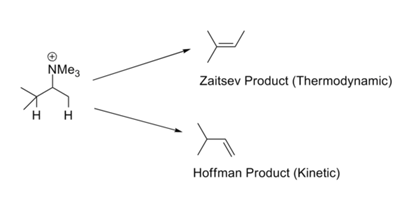
Es könnte zwei Gründe für solche Präferenzen geben. Ingold (1960) und Bunnett (1969) vermuteten, dass eine positiv geladene Abgangsgruppe den Säuregrad der β-Protonen erhöht. Ein Substituent an der β-Position könnte hyperkonjugativ die Acidität des β-Protonen verringern. Folglich ist eine endständige Methylgruppe (die keinen Alkylsubstituenten hat) saurer als das innere Methinproton (das mindestens einen Alkylsubstituenten trägt). Wenn die Abgangsgruppe ein Halogen ist, verschiebt sich der Mechanismus in Richtung E1. Unter diesen Bedingungen wird die Stabilität der entstehenden Doppelbindung wichtig, und dies führt zu dem thermodynamisch stabileren Produkt. Die Schule von H.C. Brown hatte vorgeschlagen (1956), dass solche Eliminierungsreaktionen von sterischen Faktoren bestimmt werden. Die geladenen Abgangsgruppen sind im Vergleich zu den neutralen Abgangsgruppen groß.
Die größeren Abgangsgruppen wie -NR3+ und -SR2+ ergeben mehr Hoffmann-Produkte als kleinere Gruppen wie Halogene. Auch die Sperrigkeit der Base erhöht das Hoffmann-Produkt auf Kosten des Zaitsav-Produkts. Die Situation scheint noch komplexer zu sein. Wenn die Stärke der Base erhöht wurde, ohne die Masse an der Reaktionsstelle (X-C6H4-O¯) zu erhöhen, stieg das Hoffmann-Produkt auf Kosten des Zaitsav-Produkts (Froemsdorf (1966,67)). Dies deutet auf einen E1cB-Mechanismus hin, bei dem die Acidität des β-Protons eine wichtige Rolle spielt. Somit könnte der Mechanismus (und damit die Zusammensetzung der Produkte) durch Faktoren wie die Größe der Abgangsgruppe, die Größe der Base, die Art der Abgangsgruppe und die Stärke der Base verändert werden.
Beitragende
- Prof. R Balaji Rao (Department of Chemistry, Banaras Hindu University, Varanasi) als Teil der Informations- und Kommunikationstechnologie