Acetilação refere-se a uma reacção que introduz um grupo funcional acetil num composto químico, no qual o átomo de hidrogénio de um grupo hidroxil é substituído por um grupo acetil (CH3 CO) para produzir um éster específico, o acetato. A acetilação da proteína geralmente tem duas formas diferentes. Em humanos, quase (80%-90%) proteínas tornam-se co-translacionadamente acetiladas em seus Nα-termini das cadeias nascentes de polipeptídeos. Outro tipo é tipicamente acetilado nos resíduos de lisina.
N-terminal acetylation
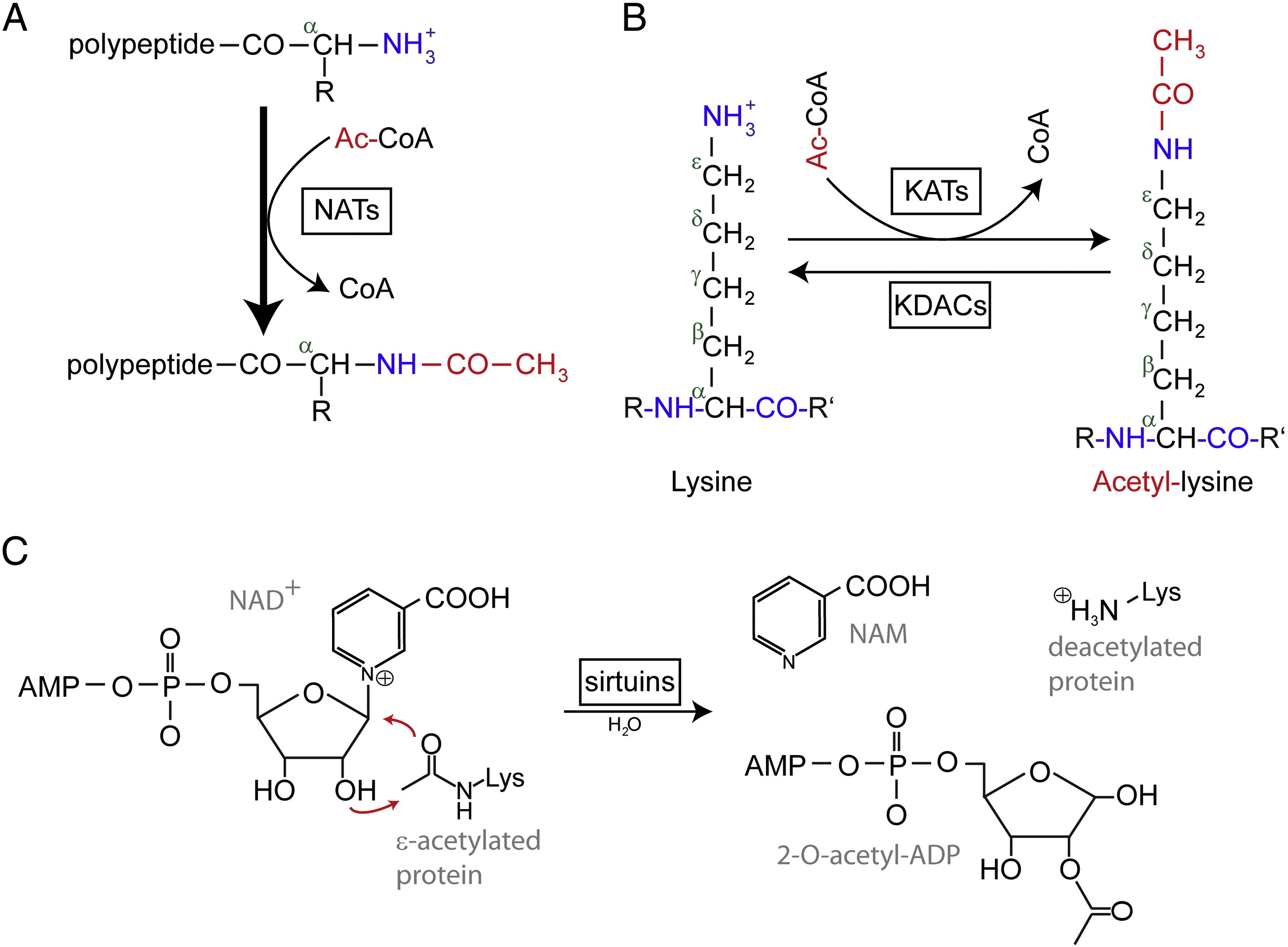
N-terminal (Nt) acetylation are catalyzed by Nt-acetyltransferases (NATs) and is found to be irreversible so far as. As NATs, enzimas mono ou multisubunidades que consistem de uma subunidade catalítica e até duas subunidades auxiliares, podem transferir um grupo acetil da acetil-coenzima A (Ac-CoA) para o grupo α-amino do primeiro resíduo aminoácido da proteína. Nos NATs, a subunidade auxiliar principal modula a atividade e a especificidade do substrato da subunidade catalítica. Diferentes NATs são responsáveis pela acetilação do Nt. Em humanos, foram encontrados até agora seis NATs, incluindo NatA, NatB, NatC, NatD, NatE, e NatF. Além da diferença na composição da subunidade, os vários NATs variam em suas especificidades de substrato.
Nt a acetilação desempenha papéis diferentes nos efeitos moleculares. Em primeiro lugar, a acetilação de Nt- determina a localização subcelular para certas proteínas. Por exemplo, Arl3 e Grh1, duas proteínas associadas a Golgi, não podem se associar com o aparelho Golgi quando falta o grupo Nt-acetil. Em segundo lugar, é relatado que a acetilação do Nt restringe as proteínas no citosol e inibe uma migração pós-tradução para o retículo endoplasmático (ER) e a via secretora. Além disso, a acetilação do Nt pode alterar as propriedades do N-termino para fazer com que as interações proteína-proteína se tornem moduladas. Foi demonstrado para várias proteínas que a afinidade com os seus parceiros aglutinadores aumentou após a acetilação do N. Por exemplo, a enzima ubiquitina ubc12 que conjuga E2 sofre a acetilação do Nt-acetylation por NatC, permitindo um aumento da afinidade com seu parceiro de interação, a ligase ubiquitina E3 Dcn1. Além disso, a acetilação N-nacetilação controla a qualidade e a vida útil da proteína e regula a estequiometria da proteína pela via da regra N-end.
N a acetilação terminal tem muitas funções na fisiologia. NATs são essenciais para o desenvolvimento normal, desenvolvimento ósseo e dos vasos sanguíneos. A acetilação N-terminal pode regular a pressão arterial, a localização do proteasoma, o hormônio, bem como a estrutura e função das organelas. Na doença humana, ela está relacionada a doenças neurodegenerativas (como a doença de Alzheimer, Parkinson e demência corporal de Lewy) e câncer (como câncer de pulmão, câncer de mama, câncer colorretal).
Acetilação da lisina
Resíduos acetilados de lisina foram descobertos pela primeira vez nas histórias que regulam a transcrição de genes. Mas a acetilação da lisina não está limitada às histonas. Ao contrário da acetilação da Nt, a acetilação da lisina é reversível. A acetilação é catalisada pelas acetiltransferases de lisina (KATs) e a desacetilação dos resíduos de lisina é catalisada pelas deacetilases de lisina (KDACs).
Foi relatado que 17-22 genes KATs foram identificados no genoma humano (O número exato de KATs é controverso), que pode ser classificado em três famílias diferentes, incluindo a família GCN5 (controle geral não-derepressivo 5) acetiltransferase (GNAT), a família MYST, e a família p300/CBP (proteína ligante CREB). Os substratos conhecidos dos complexos KAT não só incluem proteínas histônicas, mas alguns fatores de transcrição diferentes, co-reguladores transcripcionais e algumas proteínas de vias de sinalização celular específicas como p53, β-catenin, NF-κB, MyoD ou Rb. E mesmo algumas moléculas de RNA podem ser acetiladas. Existem quatro tipos diferentes de KDACs, incluindo as Classes I, II, III, e IV. As classes I, II e IV são Zn2 + amidoidrolases dependentes, enquanto a classe III (também chamada de sirtuínas) usa NAD+ como co-substrato para sua atividade catalítica são Zn2 + amidoidrolases dependentes.
As histonas são as primeiras proteínas acetiladas descobertas. As moléculas de histonas são modificadas por diferentes PTMs, incluindo fosforilação, metilação e acetilação. a acetilação de histonas, determinam a montagem de histonas, bem como a dobra e compactação da interação DNA-histona e, portanto, apresentam uma troca entre a estrutura permissiva e repressiva da cromatina. Além das histonas, os KATs podem catalisar as proteínas citoesqueléticas. Existem alguns novos sítios de acetilação identificados em outras proteínas, incluindo proteínas HMG, c-Myc, receptores de estrogênio e androgênio, E2F/Rb e assim por diante.
Os papéis fisiológicos da acetilação da lisina têm sido relatados. As proteínas histonais estão associadas a uma regulação rigorosa de essencialmente todos os tipos de processos de DNA como transcrição, replicação, recombinação, reparação, bem como tradução e formação de estruturas cromatinosas especializadas. Portanto, a acetilação da proteína lisina afeta uma gama de vias de sinalização celular, bem como o metabolismo, respostas ao estresse, apoptose e tráfico de membranas.
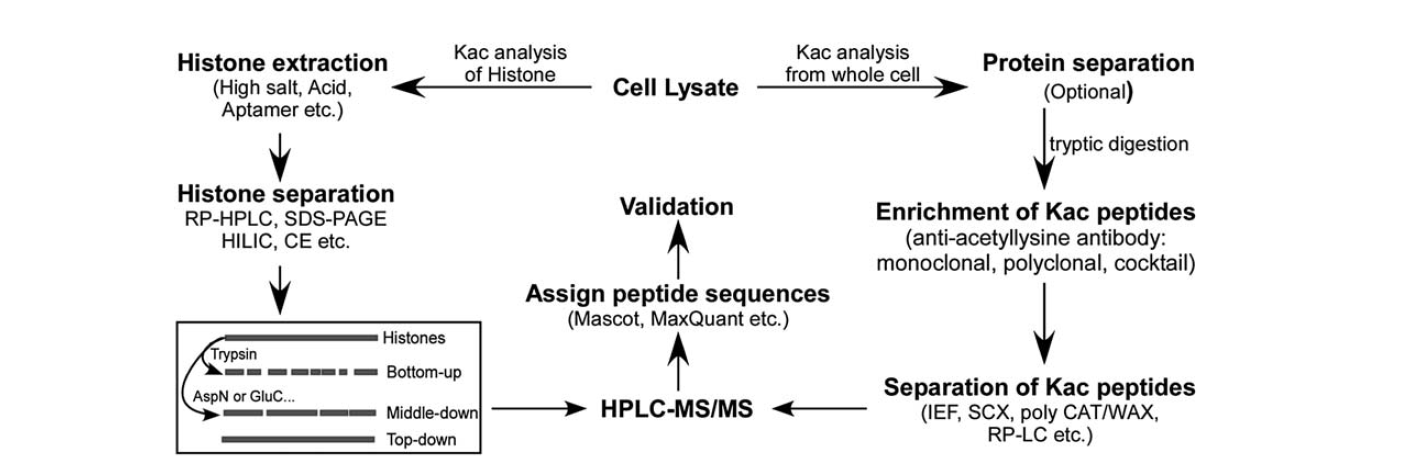
Há relativamente menos ferramentas disponíveis para identificar a acetilação da lisina. Com o desenvolvimento da espectrometria de massa, tem sido uma importante ferramenta para a identificação e quantificação da acetilação da lisina. Para analisar a acetilação da lisina na história, existem várias etapas, incluindo lisado celular, extração de histone, separação de histone, espectrometria de massa e análise de dados. As etapas de análise para a acetilação da lisina de proteína de toda a célula incluem lisado celular, separação de proteínas, enriquecimento dos peptídeos de acetilação da lisina, separação dos peptídeos de acetilação da lisina, espectrometria de massa e análise de dados.