Estas alterações conformacionais também trazem resíduos catalíticos no local ativo perto das ligações químicas no substrato que serão alteradas na reação. Após a ligação, um ou mais mecanismos de catálise diminuem a energia do estado de transição da reação, fornecendo uma via química alternativa para a reação. Existem seis possíveis mecanismos de catálise “através da barreira” assim como um mecanismo “através da barreira”:
- Proximidade e orientaçãoEditar
- Doadores ou aceitadores de prótonsEditar
- Catálise eletrostáticaEditar
- Catálise covalenteEditar
- Catálise iônica metálicaEditar Um íon metálico no local ativo participa da catálise coordenando a estabilização da carga e a blindagem. Devido à carga positiva de um metal, apenas cargas negativas podem ser estabilizadas através de íons metálicos. Entretanto, os íons metálicos são vantajosos na catálise biológica porque não são afetados por mudanças no pH. Os iões metálicos também podem actuar para ionizar a água, actuando como ácido Lewis. Os íons metálicos também podem ser agentes de oxidação e redução.
- Estirpe de ligaçãoEditar
- Tunelização quânticaEditar
- EnzymeEdit ativo
Proximidade e orientaçãoEditar
Interações enzima-substrato alinham os grupos químicos reativos e os mantêm juntos em uma geometria ótima, o que aumenta a taxa da reação. Isto reduz a entropia dos reagentes e assim torna as reacções de adição ou transferência menos desfavoráveis, uma vez que uma redução da entropia global quando dois reagentes se tornam um único produto. No entanto, este é um efeito geral e é visto nas reacções de não adição ou transferência onde ocorre devido a um aumento na “concentração efectiva” dos reagentes. Isto é compreendido quando se considera como os aumentos na concentração levam a aumentos na taxa de reação: essencialmente quando os reagentes são mais concentrados, eles colidem mais frequentemente e assim reagem mais frequentemente. Na catálise enzimática, a ligação dos reagentes à enzima restringe o espaço conformacional dos reagentes, mantendo-os na “orientação adequada” e próximos uns dos outros, para que a colisão seja mais frequente, e com a geometria correcta, para facilitar a reacção desejada. A “concentração eficaz” é a concentração que o reagente teria que estar, livre em solução, para experimentar a mesma frequência de colisão. Muitas vezes tais concentrações teóricas efetivas não são físicas e impossíveis de realizar na realidade – o que é uma prova do grande poder catalítico de muitas enzimas, com aumentos maciços da taxa sobre o estado não catalisado.
Por exemplo:
Reações semelhantes ocorrerão muito mais rapidamente se a reação for intramolecular.

A concentração efetiva de acetato na reação intramolecular pode ser estimada como k2/k1 = 2 x 105 Molar.
No entanto, a situação pode ser mais complexa, uma vez que estudos computacionais modernos estabeleceram que exemplos tradicionais de efeitos de proximidade não podem ser relacionados diretamente aos efeitos antrópicos da enzima. Além disso, a proposta antrópica original foi encontrada para sobrestimar amplamente a contribuição da entropia de orientação para a catálise.
Doadores ou aceitadores de prótonsEditar
Doadores e aceitadores de prótons, ou seja, ácidos e base podem doar e aceitar prótons a fim de estabilizar as cargas em desenvolvimento no estado de transição. Isto está relacionado com o princípio geral da catálise, o de reduzir as barreiras energéticas, uma vez que em geral os estados de transição são estados de alta energia, e ao estabilizá-los esta alta energia é reduzida, baixando a barreira. Uma característica chave da catálise enzimática sobre muitas catálises não-biológicas, é que tanto a catálise ácida como a catálise de base podem ser combinadas na mesma reação. Em muitos sistemas abióticos, ácidos (grandes) ou bases (pias de grande concentração H+, ou espécies com pares de electrões) podem aumentar a taxa da reacção; mas claro que o ambiente só pode ter um pH geral (medida da acidez ou basicidade (alcalinidade)). No entanto, como as enzimas são moléculas grandes, elas podem posicionar tanto grupos ácidos quanto grupos básicos em seu local ativo para interagir com seus substratos, e empregar ambos os modos independentemente do pH do volume.
A maioria das vezes, ácido geral ou catálise de base é empregada para ativar grupos nucleófilos e/ou eletrofílicos, ou para estabilizar grupos de saída. Muitos aminoácidos com grupos ácidos ou básicos são empregados no local ativo, tais como o ácido glutâmico e aspártico, histidina, cistina, tirosina, lisina e arginina, assim como serina e treonina. Além disso, a espinha dorsal do peptídeo, com grupos carbonilo e amida N, é frequentemente empregada. Cistina e Histidina são muito comumente envolvidas, já que ambas têm um pKa próximo ao pH neutro e, portanto, ambas podem aceitar e doar prótons.
Muitos mecanismos de reação envolvendo catálise ácida/base assumem um pKa substancialmente alterado. Esta alteração do pKa é possível através do ambiente local do resíduo.
| Condições | Ácidos | Bases |
|---|---|---|
| Ambiente hidrofóbico | Increase pKa | Descrease pKa |
| Resíduos de carga semelhante | Increase pKa | Diminuir pKa |
| Formação de ponte de sal (e hidrogênio bond) |
Diminuir pKa | Diminuir pKa |
pKa também pode ser influenciado significativamente pelo ambiente ao redor, na medida em que os resíduos que são básicos em solução podem agir como doadores de prótons e vice-versa.
Por exemplo:
Tríade catalítica de uma protease serina
>
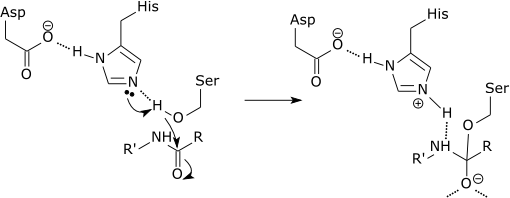 >
>>
O passo inicial do mecanismo catalítico da protease serina envolve a histidina do sítio ativo aceitando um próton do resíduo de serina. Isto prepara a serina como um nucleófilo para atacar a ligação amida do substrato. Este mecanismo inclui a doação de um próton da serina (uma base, pKa 14) à histidina (um ácido, pKa 6), possibilitada pelo ambiente local das bases.
É importante esclarecer que a modificação dos pKa’s é uma parte pura do mecanismo eletrostático. Além disso, o efeito catalítico do exemplo acima está associado principalmente à redução da pKa do oxianião e ao aumento da pKa da histidina, enquanto a transferência de prótons da serina para a histidina não é catalisada significativamente, já que não é a taxa que determina a barreira.
Catálise eletrostáticaEditar
Estabilização dos estados de transição carregados também pode ser por resíduos no sítio ativo formando ligações iônicas (ou interações de cargas iônicas parciais) com o intermediário. Estas ligações podem provir de cadeias laterais ácidas ou básicas encontradas em aminoácidos como lisina, arginina, ácido aspártico ou ácido glutâmico ou provir de cofactores metálicos como o zinco. Os iões metálicos são particularmente eficazes e podem reduzir a pKa de água o suficiente para torná-la um nucleófilo eficaz.
Estudos de simulação por computador sistemáticos estabeleceram que os efeitos electrostáticos dão, de longe, a maior contribuição para a catálise. Ele pode aumentar a taxa de reação por um fator de até 107. Em particular, verificou-se que a enzima fornece um ambiente mais polar que a água, e que os estados de transição iónica são estabilizados por dipolos fixos. Isto é muito diferente da estabilização do estado de transição na água, onde as moléculas de água devem pagar com “energia de reorganização”. A fim de estabilizar os estados iônicos e carregados. Assim, a catálise está associada ao fato dos grupos polares enzimáticos serem pré-organizados
A magnitude do campo eletrostático exercido pelo sítio ativo de uma enzima mostrou-se altamente correlacionada com o aumento da taxa catalítica da enzima
A ligação do substrato geralmente exclui a água do sítio ativo, baixando assim a constante dielétrica local para a de um solvente orgânico. Isto reforça as interacções electrostáticas entre os substratos carregados/polares e os locais activos. Além disso, estudos mostraram que as distribuições de carga sobre os locais ativos são organizadas de forma a estabilizar os estados de transição das reações catalíticas. Em várias enzimas, essas distribuições de carga aparentemente servem para guiar os substratos polares para seus locais de ligação, de modo que as taxas dessas reações enzimáticas sejam maiores do que seus limites de difusão controlados aparentemente.
Por exemplo:
Mecanismo catalítico da carboxipeptidase

O intermediário tetraédrico é estabilizado por uma ligação iônica parcial entre o íon Zn2+ e a carga negativa sobre o oxigênio.
Catálise covalenteEditar
Catálise covalente envolve o substrato formando uma ligação covalente transitória com resíduos no local ativo da enzima ou com um co-fator. Isto adiciona um intermediário covalente adicional à reação, e ajuda a reduzir a energia de estados de transição posteriores da reação. A ligação covalente deve, em um estágio posterior da reação, ser quebrada para regenerar a enzima. Este mecanismo é utilizado pela tríade catalítica de enzimas como proteases como a quimotripsina e a tripsina, onde se forma uma enzima intermediária acil-enzima. Um mecanismo alternativo é a formação da base de schiff usando a amina livre de um resíduo de lisina, como visto na enzima aldolase durante a glicólise.
Algumas enzimas utilizam cofactores não-aminoácidos como o fosfato piridoxal (PLP) ou o pirofosfato de tiamina (TPP) para formar intermediários covalentes com moléculas reagentes. Tais intermediários covalentes funcionam para reduzir a energia de estados de transição posteriores, semelhante a como os intermediários covalentes formados com resíduos de aminoácidos ativos no local permitem a estabilização, mas as capacidades dos cofatores permitem que as enzimas realizem reações que os resíduos dos lados dos aminoácidos sozinhos não poderiam realizar. Enzimas que utilizam tais cofactores incluem a transaminase enzimática dependente de PLP aspartato e a enzima dependente de TPP desidrogenase pirúvel.
Catálise covalente fornece uma via alternativa para a reação (via para o intermediário covalente) e, portanto, é diferente da verdadeira catálise. Por exemplo, a energia da ligação covalente à molécula serina na quimotripsina deve ser comparada à bem compreendida ligação covalente ao nucleófilo na reacção não-catalítica da solução. Uma verdadeira proposta de catálise covalente (onde a barreira é inferior à barreira correspondente em solução) exigiria, por exemplo, uma ligação covalente parcial ao estado de transição por um grupo enzimático (por exemplo, uma ligação de hidrogênio muito forte), e tais efeitos não contribuem significativamente para a catálise.
Catálise iônica metálicaEditar Um íon metálico no local ativo participa da catálise coordenando a estabilização da carga e a blindagem. Devido à carga positiva de um metal, apenas cargas negativas podem ser estabilizadas através de íons metálicos. Entretanto, os íons metálicos são vantajosos na catálise biológica porque não são afetados por mudanças no pH. Os iões metálicos também podem actuar para ionizar a água, actuando como ácido Lewis. Os íons metálicos também podem ser agentes de oxidação e redução.
Estirpe de ligaçãoEditar
Este é o principal efeito da ligação por encaixe induzido, onde a afinidade da enzima ao estado de transição é maior do que ao próprio substrato. Isto induz rearranjos estruturais que deformam as ligações do substrato numa posição mais próxima da conformação do estado de transição, diminuindo assim a diferença de energia entre o substrato e o estado de transição e ajudando a catalisar a reacção.
No entanto, o efeito de deformação é, de facto, um efeito de desestabilização do estado do solo, em vez do efeito de estabilização do estado de transição. Além disso, as enzimas são muito flexíveis e não podem aplicar grande efeito de tensão.
Além da tensão de ligação no substrato, a tensão de ligação também pode ser induzida dentro da própria enzima para ativar resíduos no local ativo.
Por exemplo:
Substrato, substrato ligado e conformações de estado de transição da lisozima.
O substrato, na ligação, é distorcida a partir da conformação da meia cadeira do anel hexagonal (devido ao obstáculo estéreo com aminoácidos da proteína forçando o equatorial c6 a estar na posição axial) na conformação da cadeira
Tunelização quânticaEditar
Estes mecanismos tradicionais de “sobre a barreira” têm sido desafiados em alguns casos por modelos e observações de mecanismos de “através da barreira” (tunelização quântica). Algumas enzimas operam com cinética que são mais rápidas do que o que seria previsto pelo clássico ΔG‡. Nos modelos “através da barreira”, um próton ou um elétron pode fazer um túnel através de barreiras de ativação. A tunelização quântica para prótons tem sido observada na oxidação da triptamina por amina desidrogenase aromática.
A tunelização quântica não parece fornecer uma grande vantagem catalítica, uma vez que as contribuições da tunelização são semelhantes nas reações catalisadas e não catalisadas em solução. Entretanto, a contribuição da tunelização (tipicamente melhorando as constantes de taxa por um fator de ~1000 comparado com a taxa de reação para a rota clássica “sobre a barreira”) é provavelmente crucial para a viabilidade dos organismos biológicos. Isto enfatiza a importância geral das reações de tunelização em biologia.
Em 1971-1972 o primeiro modelo quântico-mecânico de catálise enzimática foi formulado.
EnzymeEdit ativo
A energia de ligação do complexo enzimático-substrato não pode ser considerada como uma energia externa que é necessária para a ativação do substrato. A enzima de alto conteúdo energético pode primeiro transferir algum grupo energético específico X1 do local catalítico da enzima para o local final do primeiro reagente ligado, depois outro grupo X2 do segundo reagente ligado (ou do segundo grupo do reagente único) deve ser transferido para o local ativo para terminar a conversão do substrato em produto e regeneração enzimática.
Podemos apresentar toda a reacção enzimática como duas reacções de acoplamento:
|
S 1 + EX 1 ⟶ S 1 EX 1 ⟶ P 1 + EP 2 {\displaystyle {\ce {{{S1}+ EX1 -> S1EX1 -> {P1}+ EP2}}}
 |
|
(1) |
|
S 2 + EP 2 ⟶ S 2 EP 2 ⟶ P 2 + EX 2 {\displaystyle {\ce {\S2}+ EP2 -> S2EP2 -> {P2}+ EX2}}}
 |
|
(2) |
Pode ser visto pela reacção (1) que o grupo X1 da enzima activa aparece no produto devido à possibilidade da reacção de troca dentro da enzima para evitar tanto a inibição electrostática como a repulsão dos átomos. Portanto, representamos a enzima ativa como um poderoso reagente da reação enzimática. A reacção (2) mostra uma conversão incompleta do substrato porque o seu grupo X2 permanece dentro da enzima. Esta abordagem como idéia tinha anteriormente proposto confiar nas hipotéticas conversões enzimáticas extremamente altas (enzima catalítica perfeita).
O ponto crucial para a verificação da presente abordagem é que o catalisador deve ser um complexo da enzima com o grupo de transferência da reação. Este aspecto químico é suportado pelos mecanismos bem estudados das várias reacções enzimáticas. Considere a reação de hidrólise de ligação peptídeo catalisada por uma proteína pura α-cimotripsina (uma enzima agindo sem co-fator), que é um membro bem estudado da família das proteases serinas, veja.
Apresentamos os resultados experimentais desta reacção como duas etapas químicas:
|
S 1 + EH ⟶ P 1 + EP 2 {\displaystyle {\ce {\S1}+ EH -> {P1}+ EP2}}}
 |
|
(3) |
|
EP 2 + H – O – H ⟶ EH + P 2 {\i}displaystyle {\i}ce {\i}+ {\i1}H-O-H}-> {EH}+ P2}}}
 |
|
(4) |
Onde S1 é um polipeptídeo, P1 e P2 são produtos. O primeiro passo químico (3) inclui a formação de um intermediário covalente acil-enzimático. O segundo passo (4) é a etapa da desacylação. É importante notar que o grupo H+, inicialmente encontrado na enzima, mas não na água, aparece no produto antes da etapa de hidrólise, portanto pode ser considerado como um grupo adicional da reação enzimática.
Assim, a reação (3) mostra que a enzima age como um poderoso reagente da reação. De acordo com o conceito proposto, o transporte de H da enzima promove a primeira conversão do reagente, quebra da primeira ligação química inicial (entre os grupos P1 e P2). A etapa de hidrólise leva à quebra da segunda ligação química e regeneração da enzima.
O mecanismo químico proposto não depende da concentração dos substratos ou produtos no meio. No entanto, uma mudança na sua concentração provoca principalmente mudanças de energia livre no primeiro e último passo das reacções (1) e (2) devido às mudanças no conteúdo de energia livre de cada molécula, seja S ou P, em solução aquosa.Esta abordagem está de acordo com o seguinte mecanismo de contracção muscular. O passo final da hidrólise de ATP no músculo esquelético é a liberação do produto causada pela associação das cabeças de miosina com actina. O fechamento da fenda de ligação da actina durante a reação de associação é estruturalmente acoplado com a abertura da bolsa de ligação dos nucleotídeos no local ativo da miosina.
Notavelmente, os passos finais da hidrólise de ATP incluem a liberação rápida do fosfato e a liberação lenta do ADP.A liberação de um ânion fosfato do ânion ADP ligado em solução aquosa pode ser considerada como uma reação exergônica porque o ânion fosfato tem baixa massa molecular.
Assim, chegamos à conclusão de que a liberação primária do fosfato inorgânico H2PO4- leva à transformação de uma parte significativa da energia livre da hidrólise de ATP em energia cinética do fosfato solvado, produzindo fluxo ativo. Esta suposição de uma transdução mecano-química local está de acordo com o mecanismo de contração muscular de Tirosh, onde a força muscular deriva de uma ação integrada de fluxo ativo criada pela hidrólise de ATP.