O uso e a importância das células e baterias são inquestionáveis. No nosso dia a dia, vidas, fazemos uso de células de tantas maneiras diferentes. Agora, nos últimos poucos conceitos, já o introduzimos às pilhas em geral. No entanto, aqui vamos dar-lhe uma análise aprofundada das células galvânicas. Então, vamos começar.
>
Vídeos gravados
Células Galvânicas
Entre outras células, uma célula galvânica é um tipo de célula electroquímica. É utilizada para fornecer corrente eléctrica, fazendo a transferência de electrões através de uma reacção redox. Uma célula galvânica é uma idéia exemplar de como a energia pode ser aproveitada utilizando reações simples entre alguns elementos determinados. É surpreendente estudar como uma célula galvânica pode ser montada e utilizada para obter energia.
Explicando nos termos mais simples, uma célula galvânica funciona como um dispositivo no qual ocorrem simultaneamente reacções de oxidação e de redução. Estas reacções são utilizadas para converter a energia química em energia eléctrica, que pode ser utilizada para quaisquer fins comerciais.
Passar mais tópicos em Electroquímica
- Baterias
- Condutância de Soluções Electrolíticas
- Corrosão
- Células Electroquímicas
- Células Electrolíticas e Electrólise
- Células de combustível
- Equação deernst
- Variação de condutividade e condutividade molar com concentração
Trabalho de células galvânicas

O trabalho de uma célula galvânica é bastante simples. Envolve uma reacção química que torna a energia eléctrica disponível como resultado final. Durante uma reacção redox, uma célula galvânica utiliza a transferência de energia entre electrões para converter energia química em energia eléctrica.
Célula Galvânica utiliza a capacidade de separar o fluxo de electrões no processo de oxidação e redução, provocando uma meia reacção e ligando cada uma delas com um fio para que se possa formar um caminho para o fluxo de electrões através desse fio. Este fluxo de elétrons é essencialmente chamado de corrente. Tal corrente pode ser feita para fluir através de um fio para completar um circuito e obter a sua saída em qualquer dispositivo como uma televisão ou um relógio.
Uma célula galvânica pode ser feita de quaisquer dois metais. Estes dois metais podem formar o ânodo e o cátodo, se deixados em contacto um com o outro. Esta combinação permite a corrosão galvânica daquele metal que é mais anódico. Um circuito de ligação deve ser necessário para permitir esta corrosão.
Configuração de uma célula galvânica
Para criar uma célula galvânica, seria necessário passar pela seguinte configuração. O ideal seria que a célula incluísse dois eléctrodos. Um desses eletrodos, o cátodo, deve ser um eletrodo com carga positiva enquanto o outro, deve ser o ânodo, o eletrodo com carga negativa.
Esses dois eletrodos devem formar os dois componentes essenciais da célula galvânica. A reação química relacionada à redução deve ocorrer no cátodo, enquanto a meia reação de oxidação deve ocorrer no ânodo. Como já foi dito, dois metais quaisquer podem ser usados para criar a reação química.
Entendendo a célula galvânica com um Exemplo
Vejamos um exemplo onde os dois metais envolvidos na reação química são o zinco e o cobre. Como a reação química ocorre, o zinco acabaria perdendo dois elétrons. Isto será absorvido pelo cobre para se transformar em cobre elementar. Como estes dois metais serão colocados em dois recipientes separados e serão ligados por um fio condutor, formar-se-á uma corrente eléctrica, que transferirá todos os electrões de um metal para outro.
Ao mesmo tempo, os dois metais serão imersos numa solução salina, digamos, sulfato de Zinco e sulfato de Cobre neste caso. Neste caso, as duas soluções não são misturadas diretamente, mas podem ser unidas usando uma ponte ou um meio. Este meio deve ser responsável pela transferência de íons, mas também certificar-se de que as duas soluções não venham a se misturar uma com a outra.
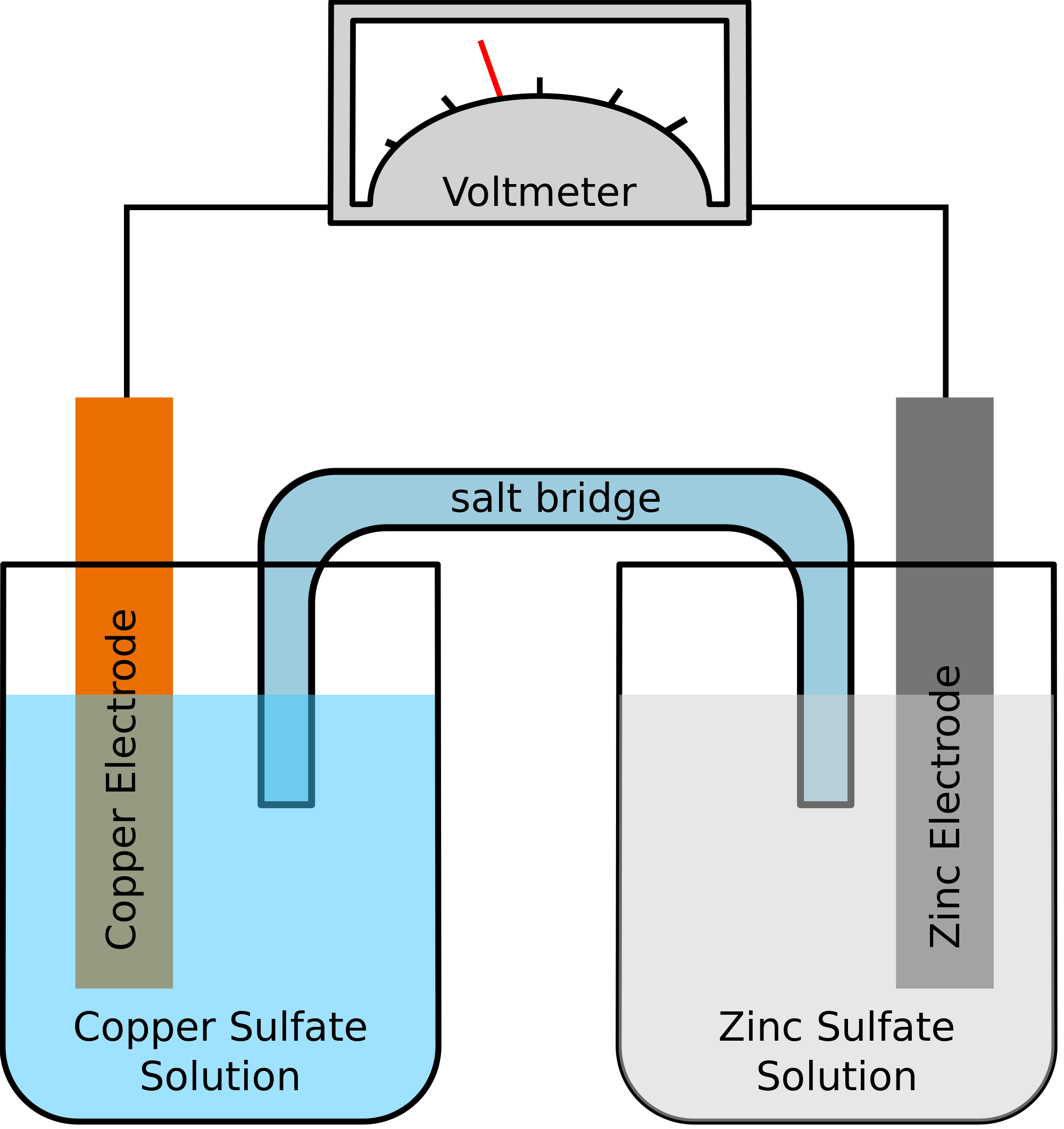
Tal ponte ajuda a completar o circuito de transporte da carga elétrica e também assegura que as soluções nos recipientes com os metais permaneçam neutras e não se misturem uma com a outra. Desde que a ponte de sal não interfira com a reacção redox, sob a qual a oxidação e redução estão a ocorrer, não importa qual ponte de sal está a ser utilizada na reacção química.
alguns termos importantes
alguns dos termos importantes colocados em uso numa célula galvânica estão listados abaixo:
- Limites de fase: Refere-se aos dois metais que agem como catodo e anodo.
- Ponte de sal: A ponte de ligação ou meio que permite uma reacção redox.
- Oxidação e redução: Os processos químicos que permitem que a corrente elétrica se forme e flua através de uma célula galvânica.
Exemplos resolvidos para você
Question: Em uma célula galvânica, o que aconteceria se nenhuma ponte de sal fosse usada enquanto a reação redox ocorresse?
Solução: Na ausência de uma ponte de sal dentro de cada recipiente contendo os metais, a reação redox começaria de forma muito semelhante. Mas na ausência da ponte de sal, o mesmo chegaria a um fim bastante abrupto. As respectivas soluções não serão capazes de manter a sua neutralidade eléctrica. Fora isso, não haverá mudança na reação química ou qualquer alteração de qualquer tipo por causa da ausência da ponte de sal ou meio.