
Quando o gás cloro é borbulhado através de um cilindro de suco de tomate, a mistura cloro/ suco de tomate fica quase completamente branca em cinco minutos. Esta mudança espetacular é resultado da ação química do cloro, atuando como um agente branqueador oxidante, sobre os pigmentos do suco de tomate. Quando recortes de jornais velhos, descoloridos através do envelhecimento e exposição à luz, são tratados com solução aquosa de boroidreto de sódio a 1%, o papel é dramaticamente branqueado em vinte minutos. Neste caso, o papel foi restaurado à sua cor branca original pela ação do boroidreto de sódio atuando como um agente branqueador redutor.
Um agente branqueador é uma substância que pode branquear ou descolorir outras substâncias. As substâncias coloridas geralmente contêm grupos de átomos, chamados cromóforos, que podem absorver a luz visível com comprimentos de onda específicos e característicos e refletir ou transmitir a parte da luz que não é absorvida. Por exemplo, se um cromóforo absorver a luz azul, ele refletirá a luz da cor complementar, e a substância contendo o cromóforo parecerá amarela. Os agentes branqueadores destroem essencialmente os cromóforos (removendo assim a cor), através da oxidação ou redução destes grupos absorventes. Assim, os branqueadores podem ser classificados como agentes oxidantes ou agentes redutores.
Algumas das utilizações dos agentes branqueadores são:
- O branqueamento de têxteis e tecidos
- O branqueamento de pasta de madeira
- A remoção de corantes
- Lavagem e limpeza comercial e doméstica
- Como ingredientes em produtos de limpeza e lavagem de louça
- O branqueamento dos cabelos
Branqueadores oxidantes
Um grande número de branqueadores oxidantes foram revistos por Jules A. Szilard em Agentes e Técnicas de Branqueamento (1973). Os branqueadores oxidantes (e agentes branqueadores) de uso comum hoje em dia são: cloro, dióxido de cloro, hipoclorito alcalino, peróxido de hidrogênio, compostos peroxigenados, luz solar e artificial.
Cloro (Cl 2 ). A descoberta do cloro pelo químico sueco Carl Wilhelm Scheele em 1774 marcou o início da era moderna do cloro. Segundo Sidney M. Edelstein, em um artigo de jornal de 1948 intitulado “The Role of Chemistry in the Development of Dyeing and Bleaching”, o químico francês Claude-Louis Berthollet foi o primeiro a usar cloro para alvejar tecidos de algodão e linho.
O cloro foi usado para branquear a polpa de madeira. Muitas fábricas de celulose empregando o processo de polpação Kraft preparam hidróxido de sódio (necessário para digerir cavacos de madeira) no local através da eletrólise da salmoura, uma solução aquosa concentrada de cloreto de sódio.
2NaCl + 2H 2 O → 2NaOH + H 2 + Cl 2 (1)
O cloro é um produto secundário. O branqueamento posterior com cloro da pasta castanha dá um produto que pode ser utilizado para a fabricação de papel de escrita e impressão. Infelizmente, os compostos orgânicos da polpa são oxidados e clorados, produzindo pequenas quantidades de compostos organoclorados, incluindo
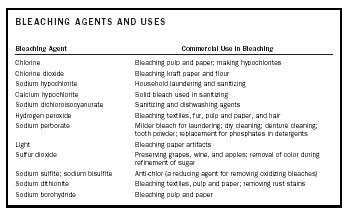
| AGENTES LIMPANTES E UTILIZAÇÕES | |
| Agente Branqueador | Uso Comercial no Branqueamento |
| Cloro | Branqueamento de pasta e papel; fazer hipoclorito |
| Dióxido de cloro | Branqueamento de papel kraft e farinha |
| Hipoclorito de sódio | Branqueamento e higienização doméstica |
| Cálcio hipoclorito | Lixívia sólida usada em higienização |
| Dicloroisocianurato de sódio | Agentes higienizantes e lavantes de louça |
| Peróxido de hidrogénio | Têxteis branqueadores, peles, pasta e papel, e cabelo |
| Perborato de sódio | Branqueador mais suave para lavagem; limpeza a seco; limpeza de dentaduras; pó de dentes; substituição de fosfatos em detergentes |
| Luz | Artefactos de papel branqueador |
| Dióxido de enxofre | Conservação de uvas, vinho e maçãs; remoção da cor durante o refinamento do açúcar |
| Sulfito de sódio; bissulfito de sódio | Anti-cloro (agente redutor para remoção de descolorantes oxidantes) |
| Ditionito de sódio | Branqueamento de têxteis, polpa e papel; remoção de manchas de ferrugem |
| Borohidreto de sódio | Branqueamento de pasta e papel |
dioxinas. De fato, a dioxina mais abundante produzida pelo processo de polpa e branqueamento, 2,3,7,8-tetraclorodibenzo- p -dioxina (2,3,7,8-TCDD), foi encontrada como cancerígena e tóxica mortal. Assim, o cloro como agente branqueador está a ser substituído pelos agentes branqueadores mais seguros dióxido de cloro e peróxido de hidrogénio. De fato, a tendência nas indústrias de papel e celulose é de branqueamento totalmente livre de cloro (TCF). O cloro é agora utilizado na indústria de branqueamento principalmente para preparar soluções de hipoclorito e descolorantes secos, como o hipoclorito de cálcio.
Dióxido de Cloro (ClO 2 ). O dióxido de cloro tem sido utilizado como agente branqueador tanto na sua fase gasosa como em solução aquosa. Devido à sua natureza explosiva, o dióxido de cloro na fase gasosa é frequentemente diluído com nitrogénio ou dióxido de carbono. Se armazenado ou enviado, o dióxido de cloro é passado através de água fria e mantido sob refrigeração.
O dióxido de cloro é preparado industrialmente através da redução do clorato de sódio pelo dióxido de enxofre em solução aquosa.
2NaClO 3 + SO 2 + H 2 SO 4 → 2ClO 2 + 2NaHSO 4 (2)
Um método relativamente seguro para o preparo do ClO 2 envolve a reação entre clorito de sódio (NaClO 2 ) e formaldeído (H 2 CO).
H 2 CO + H + + + ClO 2 – → HOCl + HCOOH (3)
À medida que a reacção 3 prossegue, o pH da solução cai (devido à produção de ácido fórmico). O aumento da acidez da solução promove a formação de ClO 2 , mostrado na equação 4.
HCOOH + HOCl + 2ClO 2 – → 2ClO 2 + Cl – + H 2 O + HCOO – (4)
Em solução ácida, o dióxido de cloro comporta-se como um agente oxidante. A redução completa de ClO 2 é mostrada na equação 5.
ClO 2 + 4H + + + 5 e – → Cl – + 2H 2 O (5)
As etapas individuais desta reacção de redução global produzem HClO 2 , HOCl, e Cl 2 , que se comportam todos como agentes oxidantes. Um meio ácido é necessário, pois o ClO 2 é desproporcional em solução alcalina, como mostra a equação 6.
2ClO 2 + 2OH – → ClO 3 – + ClO 2 – + H 2 O (6)
O dióxido de cloro é utilizado principalmente para o branqueamento da pasta.
Hipocloritos (OCl – ). As soluções de branqueamento com hipoclorito são feitas de NaOCl e, em menor escala, de Ca(OCl) 2 . Os hipocloritos são utilizados na lavagem, como desinfectantes, no branqueamento de pasta e têxteis, e na remoção de tinta de papel reciclado. Soluções de branqueamento comercial são obtidas através da passagem de gás cloro por hidróxido de sódio aquoso, diluído e a frio, como mostra a equação 7.
Cl 2 + 2OH – → OCl – + Cl – + H 2 O (7)
Alternativamente, o íon hipoclorito pode ser gerado pela hidrólise de compostos orgânicos nitrogênio-cloro. Alguns dos compostos de nitrogênio-cloro mais importantes utilizados desta forma são os isocianuratos clorados. Estes são utilizados em produtos de limpeza e na máquina de lavar louça.
Para ser uma lixívia eficaz, a solução de hipoclorito deve ser mantida alcalina (pH > 9,0), de forma a suprimir a hidrólise de OCl – (ver equação 8) e evitar a formação de HOCl instável.
OCl – + H 2 O → HOCl + OH – (8)
Em soluções ácidas, o HOCl forma e decompõe-se.
3HOCl → HClO 3 + 2HCl (9)
HOCl também reagirá com HCl, um dos produtos da decomposição.
HOCl + HCl → H 2 O + Cl 2 (10)
Soluções de branqueamento com hipoclorito não devem conter cátions metálicos pesados, pois estes cátions (como a luz ou o calor) promovem a decomposição do HOCl, como mostra a equação 11.
2HOCl → 2HCl + O 2 (11)
Os ingredientes ativos nos clareadores de hipoclorito variam com o pH. Em pH < 2, Cl 2 é o principal componente em solução; em pH 4 a 6, HOCl é a espécie dominante; em pH > 9, OCl – é o único componente presente. É o íon hipoclorito em solução básica que é o ingrediente activo na lixívia doméstica, que é tipicamente cerca de 5 a 6% de NaOCl. O OCl – íon oxida os cromóforos em materiais coloridos, e é ele próprio reduzido a íons cloreto e hidróxido.
OCl – + H 2 O + 2 e – → Cl – + 2OH – (12)
O processo de clareamento efetuado pelo alvejante hipoclorito comercial é freqüentemente aprimorado pelo uso de branqueadores óticos, compostos que absorvem a luz ultravioleta incidente e emitem luz visível, fazendo o tecido parecer mais brilhante e mais branco.
Peróxido de Hidrogénio (H 2 O 2 ) . O peróxido de hidrogênio pode ser preparado pela reação de peróxido de bário e ácido sulfúrico (ver equação 13). Como o sulfato de bário se precipita, o peróxido de hidrogênio é facilmente separado.
BaO 2 + H 2 SO 4 → BaSO 4 + H 2 O 2 (13)
Peróxido de hidrogênio, como agente branqueador utilizado na indústria de papel e celulose, tem a vantagem de ser não poluente. Devido à instabilidade do peróxido de hidrogênio puro, soluções aquosas são empregadas no branqueamento. À temperatura ambiente, o peróxido de hidrogênio se decompõe muito lentamente em água e oxigênio.
2H 2 O 2 → H 2 O + O 2 (14)
No entanto, a presença de cátions metálicos de transição (particularmente Fe 3+ , Mn 2+ , e Cu 2+ ) e outros catalisadores acelera dramaticamente esta reacção. Como resultado, o peróxido de hidrogênio aquoso deve ser estabilizado com agentes complexantes que sequestram os cátions metálicos de transição.
A espécie branqueadora ativa no peróxido de hidrogênio é o peridroxil ânion , OOH – , formado através da ionização do H 2 O 2 .
H 2 O 2 + H 2 O → H 3 O + + + OOH – (15)
A constante de ionização ácida do peróxido de hidrogênio é muito baixa ( K a = 2 × 10 -12 ) com o resultado que as soluções de H 2 O 2 devem ser alcalinas na ordem

para aumentar a concentração de OOH – . Na ausência de um meio alcalino, o peróxido de hidrogênio não é mais eficaz como agente branqueador. Por exemplo, a fase de descoloração do cabelo emprega frequentemente peróxido de hidrogénio (5-6%), mas também amoníaco para fornecer um meio alcalino.
Ao mesmo tempo, o pH não deve subir acima de 11, pois neste ponto a decomposição do OOH – começa a ocorrer.
2OOOH – → O 2 + 2OH – (16)
Compostos de Peroxigénio. Existem vários compostos sólidos de peroxigênio que liberam peróxido de hidrogênio quando dissolvidos em água. Estes incluem o perborato de sódio (NaBO 3 z 4H 2 O ou NaBO 2 z H 2 O 2 O 2 z 3H 2 O) e o peroxi-hidrato de sódio (2Na 2 CO 3 z 3H 2 O 2 ). A estrutura do perborato de sódio contém o peroxoanion B 2 (O 2 ) 2 (OH) 4 2- , que contém duas ligações de O-O que unem dois grupos tetraédricos BO 2 (OH) 2-. Estes compostos peroxigenados são utilizados em detergentes, produtos de limpeza de próteses e pós dentários.
Branqueamento com Luz. Branqueamento que envolve luz solar natural ou artificial tem sido usado para remover manchas de artefatos de papel e para tratar tecidos. O material a ser branqueado é primeiro imerso numa solução alcalina de bicarbonato de cálcio ou magnésio, e depois protegido da radiação ultravioleta, cobrindo-o com Plexiglas, Lexan, ou Mylar. A exposição à luz é então permitida por duas a quatro horas, para a luz solar natural, e duas a doze horas, para a luz artificial.
Redução de lixívia
Agentes redutores usados no branqueamento incluem sulfitos, bissulfitos, ditionitos e boroidrido de sódio, todos eles usados no branqueamento de polpa e têxtil.
Sulfitos (SO 3 2- ) e Bisulfitos (HSO 3 – ). O estado de oxidação do enxofre em ambos SO 3 2- e HSO 3 – é +4, e a oxidação para +6 ocorre prontamente, com a formação de SO 4 2- e HSO 4 – , respectivamente, tornando os sulfitos e os bissulfitos bons agentes redutores.
Dithionites (S 2 O 4 2- ) . Tanto a ditionita de sódio como a ditionita de zinco têm encontrado utilização no branqueamento de polpas mecânicas e têxteis. A preparação do íon ditionito é realizada através da redução do íon bissulfito e dióxido de enxofre com pó Zn.
2HSO 3 – + SO 2 + Zn → Zn 2+ + S 2 O 4 2- + SO 3 2- + H 2 O (17)
O ião ditionito, S 2 O 4 2- , que tem enxofre no estado de +3 oxidação, comporta-se como um forte agente redutor em solução alcalina.
S 2 O 4 2- + 4OH – → 2SO 3 2- 2H 2 O + 2 e – (18)
À medida que o pH é reduzido, o poder redutor do íon ditionite cai, como previsto pelo princípio de LeChatelier.
Os ditionitos são úteis na remoção de manchas de ferrugem, e soluções de citrato neutro de Na 2 S 2 O 4 foram usadas para remover produtos de corrosão de ferro de objectos recuperados do Titanic.
Borohidreto de Sódio (NaBH 4 ). O borohidreto de sódio tem sido utilizado principalmente no branqueamento industrial de polpas mecânicas. O BH 4 – ion é um forte agente redutor em solução alcalina.
BH 4 – + 10OH – → BO 3 3- + 8 e – + 7H 2 O (19)
Um problema com o uso de boroidreto de sódio é que o íon BH 4 – ião se decompõe lentamente em solução aquosa.
BH 4 – + 4H 2 O → B(OH) 4 – + 4H 2 (20)
Como método alternativo, o BH 4 – sais pode ser dissolvido em CH 3 OH ou no menos tóxico C 2 H 5 OH. A decomposição do BH 4 – íon em álcoois ocorre a uma taxa muito mais lenta:
BH 4 – + 4ROH → B(OR) 4 – + 4H 2 (R = CH 3 , C 2 H 5 ) (21)
Conclusão
Um agente branqueador pode branquear ou descolorir uma substância reagindo com os cromóforos responsáveis pela cor da substância. Dependendo da natureza dos cromóforos, o agente branqueador será ou um agente oxidante ou redutor. Ou seja, o cromóforo é oxidado ou reduzido para produzir uma substância incolor ou branqueada. Os agentes branqueadores e seus usos comerciais estão resumidos na Tabela 1.