Tendência 2: Para os oxoácidos de um determinado átomo central, a acidez aumenta com o estado de oxidação do elemento central ou, em outras palavras, com o número de oxigénio ligado ao átomo central.
Aqui está a tendência para os ácidos em que há números variáveis de oxigénio ligado a um determinado átomo central. Um exemplo é a série dos ácidos perclórico (celo (ClO_4^)), clórico (celo (ClO_3^)), cloroso (celo (ClO_2^)), e hipócloro (celo (ClO^)). Em tais séries, quanto maior o número de oxigenados, mais forte o ácido. Isto pode ser explicado de várias maneiras. Do ponto de vista do próprio ácido o fator chave é novamente o efeito indutivo, neste caso envolvendo a capacidade dos oxigenados ligados ao átomo central de puxar a densidade de elétrons através da ligação OH. Isto é visto no diagrama de densidade de carga dos oxoácidos de cloro mostrado na Figura \PageIndex (1), no qual a carga parcialmente positiva sobre o hidrogênio ácido aumenta com o número de oxigenados presentes.
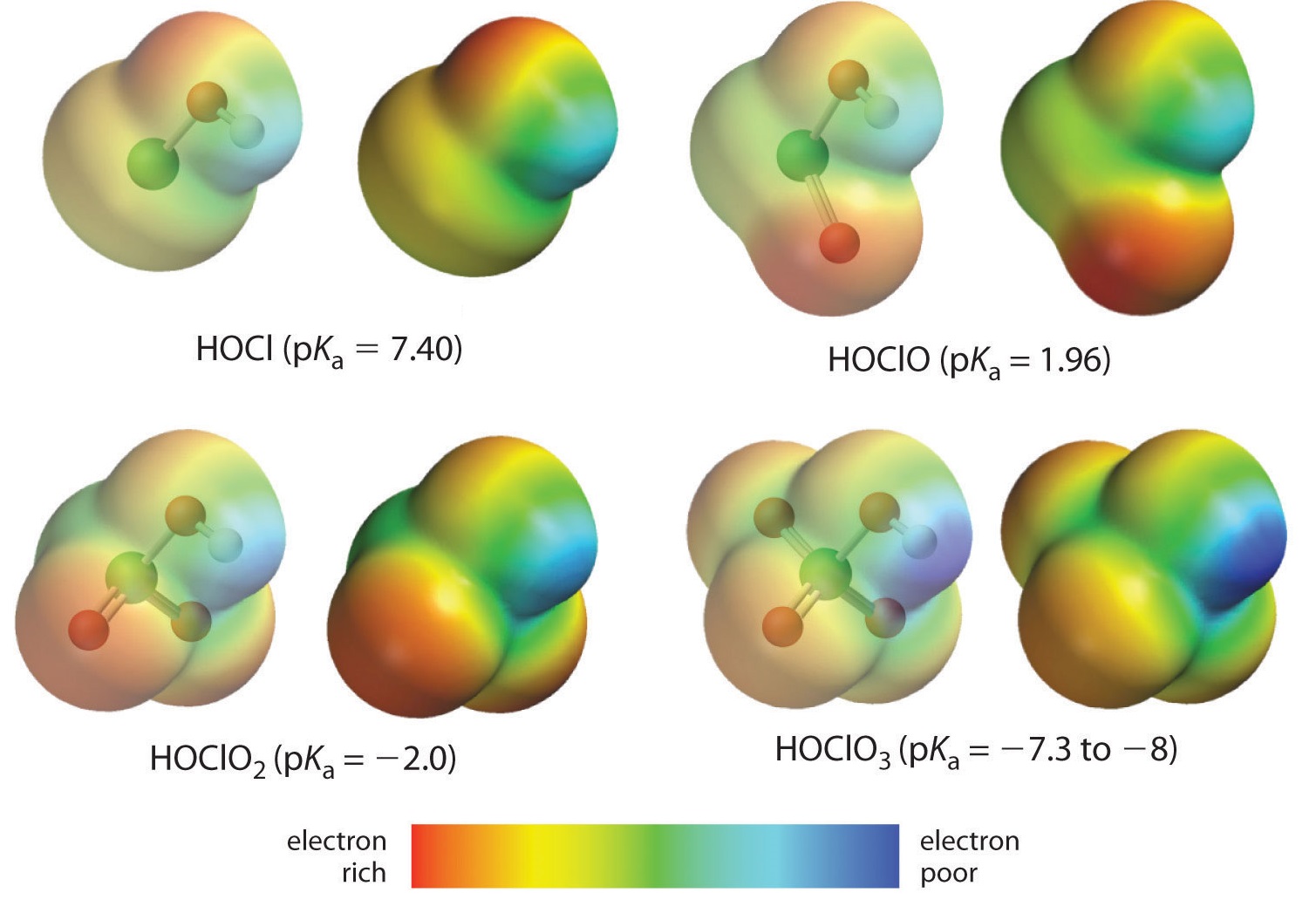
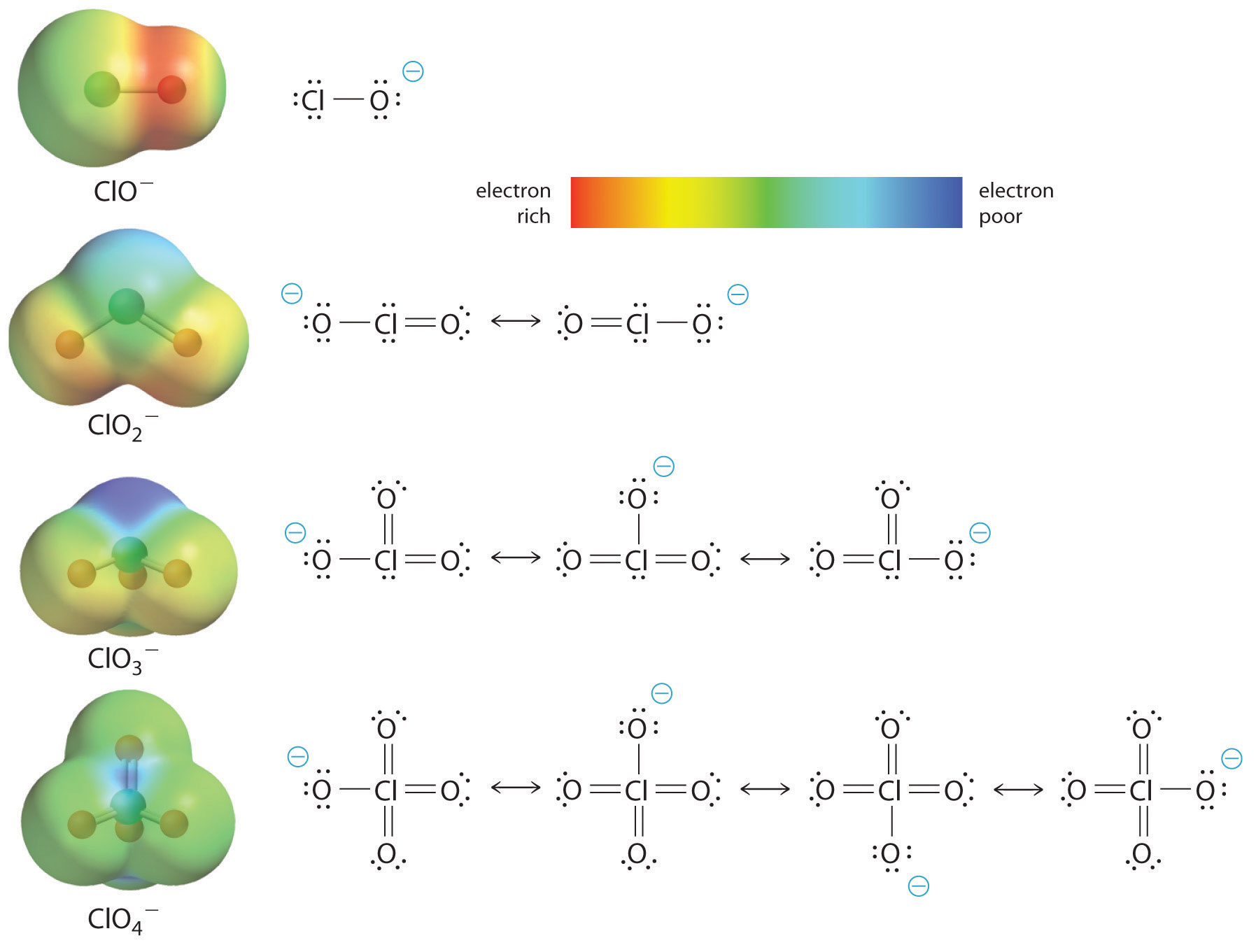
O aumento da acidez oxoácida com o número de oxigénio ligado ao átomo central também pode ser visto considerando a estabilidade do oxianião conjugado. Que a estabilidade da base conjugada aumenta com o número de oxigenados pode ser vista nos diagramas de distribuição de carga e nos modelos de ligação de Lewis para os oxianions de cloro mostrados na figura {2}(PageIndex{2}). À medida que a carga negativa se espalha por mais átomos de oxigênio ela se torna cada vez mais difusa.
Exercício {1}(\PageIndex{1})
Sulfur e selênio, ambos formam oxoácidos de fórmula {(\ce{H_2EO_4}) onde E é S ou Se. Estes são chamados ácido sulfuroso e selenoso, respectivamente. Que oxoácido você esperaria ser mais ácido: ácido selenoso ou ácido sulfuroso?
Resposta
Ácido sulfuroso deve ser mais ácido. Como o enxofre é mais electronegativo que o enxofre de selênio polarizará as ligações OH em maior extensão, tornando-as mais ácidas. Esta previsão é confirmada por uma comparação dos valores {\i1}(pK_a}) para os ácidos:
| Ácido | \(pK_{a1}) | \(pK_{a2}) |
|---|---|---|
| ácido sulfuroso, \(H_2SO_3\) | 1.85 | 7,2 |
| ácidoelenoso, \(H_2SeO_3\) | 2,62 | 8,32 |