Em reacções como a Metilação Exaustiva de Hofmann – reacções de eliminação, a olefina menos substituída é geralmente formada como um produto principal. Isto é chamado a Regra de Hofmann. Todas essas reações carregam grupos como -NR3+ ou -SR2+ e envolvem bases fortes. A Regra de Zaitsev (ou regra de Saytzeff) chama a nossa atenção para a possibilidade alternativa. Na eliminação do HX, obtém-se a olefina mais estável (Fig. 2.3.1). A aparente contradição neste conjunto de regras é facilmente resolvida através de um olhar crítico sobre os mecanismos envolvidos nestes dois conjuntos de condições de reação.
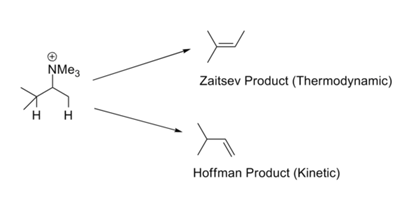
Existem duas razões para tais preferências. Ingold (1960) e Bunnett (1969) sugeriram que um grupo de saída com carga positiva aumenta a acidez dos prótons β. Um substituto na posição β poderia hiperconjugativamente diminuir a acidez do β-proton. Consequentemente, um grupo metilo terminal (que não tem substituto alquílico) é mais ácido do que o próton metano interno (com pelo menos um substituto alquílico). Quando o grupo de saída é um halogéneo, o mecanismo desloca-se para E1. Sob estas condições, a estabilidade da dupla ligação em desenvolvimento torna-se importante e isto leva ao produto termodinamicamente mais estável. A escola de H.C Brown havia sugerido (1956) que fatores estéreis regem tais reações de eliminação. Os grupos de saída carregados são grandes em comparação com os grupos de saída neutros.
Os grupos de saída maiores como -NR3+ e -SR2+ dão mais produto Hoffmann do que grupos menores como os halógenos. O volume da base também aumenta o produto Hoffmann ao custo do produto Zaitsav. A situação parece ser mais complexa. Quando a resistência da base foi aumentada sem aumentar o volume no local da reação (X-C6H4-O¯), o produto Hoffmann aumentou ao custo do produto Zaitsav (Froemsdorf (1966,67)). Isto sugere um mecanismo E1cB, onde a acidez do protão β é importante. Assim o mecanismo (e portanto a composição do produto) poderia ser alterado por fatores como o tamanho do grupo de saída, tamanho da base, natureza do grupo de saída e a força da base.
Contribuintes
- Prof. R Balaji Rao (Departamento de Química, Universidade Banaras Hindu, Varanasi) como parte da Tecnologia de Informação e Comunicação