V této sérii předvádí Colin Baker z Bedford School působivé ukázky, které mají zaujmout žákovu představivost. Demonstrace jsou snadné na přípravu, bezpečné na likvidaci a fungují.
Nic nemá takovou tendenci vtisknout chemická fakta do mysli jako předvádění zajímavých experimentů – Samuel Parkes, 1816
V září 1931 oznámil americký chemik Wallace Carothers, pracující v laboratořích společnosti DuPont, výzkum „obřích“ molekul zvaných polymery, založený na pochopení chemické struktury vlny. Jeho práce se zaměřila na vlákno označované jednoduše jako „66“, což je číslo odvozené od jeho molekulární struktury. V roce 1935 se zrodil nylon, „zázračné vlákno“, které mělo obrovský úspěch na svém původním trhu – v dámském punčochovém zboží. Když v prosinci 1941 vstoupily Spojené státy do druhé světové války, vyčlenila Rada pro válečnou výrobu veškerou výrobu nylonu pro vojenské účely, včetně padáků a pneumatik pro bombardéry B29.

Zdroj: Colin Baker
Reakce mezi dekandioyldichloridem a 1,6-diaminohexanem
Diacidchlorid v organickém rozpouštědle tvoří nemísitelnou vrstvu s alifatickým diaminem ve vodě. Na rozhraní, kde se oba bezbarvé roztoky setkávají, vzniká bílý polymer s dlouhým řetězcem. Tuto polymerní vrstvu lze z rozhraní vytáhnout a při odstraňování je okamžitě nahrazena. Přestanete-li tahat, zdá se, že se nic neděje – reakce se zastaví, ale když začnete tahat znovu, okamžitě se obnoví. Reakce může probíhat i několik hodin.

Zdroj: Colin Baker
Kit
- Cyklohexan, 100 cm3 (dráždivý, vysoce hořlavý);
- Dekanedioyl dichlorid, 5.0cm3;
- Destilovaná voda, 100cm3;
- Uhličitan sodný bezvodý, 10g;
- 1,6-diaminohexan, 5,0g;
- Dvě kádinky, 250cm3;
- Kádinka, 5cm3;
- Petrolej;
- Skleněné tyčinky.
Bezpečnost
Dekanedioyldichlorid a 1,6-diaminohexan jsou žíravé. Jsou škodlivé při požití nebo vdechnutí a při styku s kůží způsobují popáleniny. Jsou silně dráždivé. Cyklohexan je vysoce hořlavý a dráždivý.
Postup
Připravte následující dva roztoky:
Roztok A: dekandioyldichlorid v cyklohexanu. Do kádinky o objemu 250 cm3 dejte 100 cm3 cyklohexanu, přidejte 5,0 cm3 dekanedioyl dichloridu a míchejte do rozpuštění. Tento roztok vydrží asi čtyři týdny.
Roztok B: 1,6-diaminohexan ve vodném roztoku uhličitanu sodného. Do kádinky o objemu 250 cm3 nalijte 100 cm3 destilované vody, přidejte 10 g bezvodého uhličitanu sodného a míchejte do rozpuštění. Přidejte 5,0 g pevného 1,6-diaminohexanu a míchejte do rozpuštění.
Nalijte 2 cm3 roztoku A do kádinky o objemu 5 cm3. Opatrně přidejte stejný objem roztoku B. Roztok A obsahuje organické rozpouštědlo, je hustší než vodná vrstva, a proto je spodní vrstvou. Pinzetou uchopte polyamidový film (bílá pevná látka), který se začíná tvořit na rozhraní těchto dvou roztoků, a pomalu jej vytáhněte z kádinky. Omotejte vlákno kolem skleněné tyčinky a pokračujte ve vytahování. Proces zastavte, jakmile dojde k vyčerpání jedné z reaktantů.
Speciální rady
Při přidávání druhého roztoku je třeba dávat pozor, aby nedošlo k promíchání. Předveďte, jak lze vlákno vytáhnout v jednom souvislém vlákně, a poté uspořádejte soutěž o to, která dvojice studentů dokáže vyrobit nejdelší vlákno. Měli by být schopni vyrobit až 5 m, než se vlákno přetrhne. Rychle si uvědomí, že k podepření vlákna potřebují pomoc – třídu rozdělím na dvě velké skupiny, z nichž každá je vyzbrojena skleněnými tyčinkami. Moji žáci vyrobili vlákna dlouhá přes 30 m, dokonce se pokoušeli obejít rohy. Budete muset omezit maximální objem každého roztoku na 10 cm3. Studenti musí nosit rukavice a vyhnout se kontaktu s vlákny. Pokud vlákno praskne, je třeba ho zabalit do savého papíru. Případné rozlití by mělo být vytřeno savým papírem a dáno do odpadu.
Cíle výuky
Polyamidy jsou polymery, v nichž jsou opakující se jednotky drženy pohromadě amidovými vazbami, -CO-NH-.
Nylon-6,10
Nylon-6,10 je vyroben ze dvou monomerů, jeden obsahuje šest atomů uhlíku, druhý deset – odtud jeho název. Monomer s deseti uhlíky je dekandioyldichlorid (ClOC(CH2)8 COCl), kyselý chlorid se skupinou -COCl na každém konci. Druhý monomer je šestiuhlíkatý řetězec s aminoskupinou -NH2 na každém konci. Jedná se o 1,6-diaminohexan (H2 N(CH2)6 NH2, známý také jako hexan-1,6-diamin).
Při polymeraci těchto dvou sloučenin se aminová a kyselá skupina spojují, přičemž pokaždé dochází ke ztrátě molekuly chlorovodíku:
n ClOC-(CH2)8-COCl + n H2N-(CH2)6-NH2 → -(CO-(CH2)8-CONH-(CH2)6-NH)n – + n HCl
Tento polymerotvorný proces zahrnující ztrátu malé molekuly se nazývá kondenzační polymerace.
Nylon-6,6
Tento polymer vzniká kondenzací dvou šestiuhlíkatých molekul, kyseliny hexanediové a 1,6-diaminohexanu. V průmyslu se k výrobě obou monomerů používá cyklohexan. Pokud se cyklohexan oxiduje, kruh se otevře a oba konce řetězce mají kyselou skupinu – vzniká kyselina hexanediová. Pokud se tato kyselina neutralizuje amoniakem, vzniká diamoniová sůl (NH4 OOCCH2 CH2 CH2 CH2 COONH4), kterou lze dehydratovat (zahřátím na 350 °C) a redukovat (pomocí H2/Ni) na 1,6-diaminohexan. Dochází ke kondenzační polymeraci diacidu a diaminu se ztrátou vody:
n HOOC-(CH2)4 -COOH + n H2 N-(CH2)6 -NH2 → -(CO-(CH2)4 -CONH-(CH2)6 -NH)n – + n H2 O
Nylon-6
Je možné vyrobit nylon z jediného monomeru kaprolaktamu (hexahydro-2H-azepin-2-on, 1).
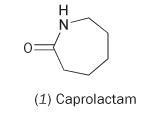
Kaprolaktam obsahuje vnitřní amidovou vazbu. Polymerizace této molekuly vede k otevření kruhu a jeho spojení za vzniku souvislého řetězce:
-(NH-(CH2)5 -CONH-(CH2)5 -CONH-(CH2)5 -CO)n –
Nylon způsobil revoluci v textilním průmyslu a byl předchůdcem mnoha dnešních moderních syntetických vláken. Stále je důležitým a široce používaným materiálem ve výrobě.