Generický název: fluocinonid
Dávkovací forma:
Medicínská recenze: Drugs.com. Naposledy aktualizováno 22. června 2020.
- Přehled
- Nežádoucí účinky
- Dávkování
- Odborné
- Interakce
- Další
Pouze na lékařský předpis
Prodej značky Lidex byl v USA ukončen.S. Pokud byla FDA schválena generická verze tohoto přípravku, mohou být k dispozici generické ekvivalenty.
- Lidex Popis přípravku
- Lidex – klinická farmakologie
- Farmakokinetika
- Indikace a použití přípravku Lidex
- Kontraindikace
- Upozornění
- Všeobecně
- Informace pro pacienta
- Laboratorní testy
- Karcinogeneze, mutageneze a poškození fertility
- Těhotenství kategorie C
- Kojící matky
- Podávání v pediatrii
- Nežádoucí účinky
- Předávkování
- Dávkování a způsob podání přípravku Lidex
- Jak se přípravek Lidex dodává
- Často kladené otázky
- Další informace o přípravku Lidex (fluocinonid lokálně)
- Zdroje pro spotřebitele
- Odborné zdroje
- Související průvodce léčbou
Lidex Popis přípravku
Lidex® (fluocinonid) gel 0,05% je určen k lokálnímu podání. Účinnou složkou je kortikosteroid fluocinonid, což je 21-acetátový ester fluocinolonacetonidu a má chemický název pregna-1,4-dien-3,20-dion,21-(acetyloxy)-6,9-difluoro-11-hydroxy-16,17–,(6α,11β,16α)-. Má následující chemickou strukturu:
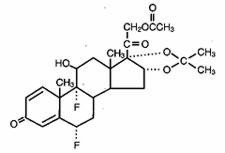
Lidex Gel obsahuje fluocinonidum 0,5 mg/g ve speciálně vytvořeném gelovém základu sestávajícím z karbomeru 940, edetanu disodného, popylgalátu, propylenglykolu, hydroxidu sodného a/nebo kyseliny chlorovodíkové (k úpravě pH) a vody (čištěné). Toto čiré, bezbarvé, tixotropní vehikulum je nemastné, nezanechává skvrny a je zcela mísitelné s vodou.
V tomto složení je účinná látka zcela v roztoku.
Lidex – klinická farmakologie
Topické kortikosteroidy mají společné protizánětlivé, protisvědivé a vazokonstrikční účinky.
Mechanismus protizánětlivé aktivity lokálních kortikosteroidů je nejasný. K porovnání a předpovědi účinnosti a/nebo klinické účinnosti topických kortikosteroidů se používají různé laboratorní metody, včetně vazokonstrikčních testů. Existují určité důkazy, které naznačují, že existuje rozpoznatelná korelace mezi účinností vazokonstriktorů a terapeutickou účinností u člověka.
Farmakokinetika
Rozsah perkutánní absorpce lokálních kortikosteroidů je určen mnoha faktory, včetně vehikula, integrity epidermální bariéry a použití okluzivních obvazů.
Topické kortikosteroidy se mohou absorbovat z normální neporušené kůže. Zánět a/nebo jiné chorobné procesy v kůži zvyšují perkutánní absorpci. Okluzivní obvazy podstatně zvyšují perkutánní absorpci lokálních kortikosteroidů. Okluzivní obvazy tak mohou být cenným terapeutickým doplňkem při léčbě rezistentních dermatóz (viz Dávkování a způsob podání).
Po vstřebání kůží se lokální kortikosteroidy zpracovávají farmakokinetickými cestami podobně jako systémově podávané kortikosteroidy. Kortikosteroidy jsou v různé míře vázány na plazmatické bílkoviny. Kortikosteroidy jsou metabolizovány především v játrech a poté jsou vylučovány ledvinami. Některé z lokálních kortikosteroidů a jejich metabolitů se také vylučují do žluči.
Indikace a použití přípravku Lidex
Lidex gel je indikován ke zmírnění zánětlivých a svědivých projevů dermatóz reagujících na kortikosteroidy.
Kontraindikace
Topické kortikosteroidy jsou kontraindikovány u pacientů s anamnézou přecitlivělosti na některou ze složek přípravku.
Upozornění
Všeobecně
Systémová absorpce lokálních kortikosteroidů způsobila u některých pacientů reverzibilní supresi osy hypotalamus-hypofýza-nadledviny (HPA), projevy Cushingova syndromu, hyperglykémii a glykosurii.
Podmínky, které zvyšují systémovou absorpci, zahrnují aplikaci silnějších steroidů, použití na velkou plochu, dlouhodobé použití a přidání okluzivního obvazu.
Pacienti, kteří dostávají velkou dávku silného lokálního steroidu aplikovaného na velkou plochu nebo pod okluzivní obvaz, by proto měli být pravidelně hodnoceni na průkaz suprese osy HPA pomocí stimulačních testů na volný kortizol v moči a ACTH. Pokud je zaznamenána suprese osy HPA, je třeba se pokusit lék vysadit, snížit frekvenci aplikace nebo jej nahradit méně účinným steroidem.
Obnovení funkce osy HPA je po vysazení léku obvykle rychlé a úplné. Ojediněle se mohou objevit příznaky a symptomy vysazení steroidů, které vyžadují doplňkové systémové kortikosteroidy.
Děti mohou absorbovat úměrně větší množství lokálních kortikosteroidů a být tak náchylnější k systémové toxicitě (viz PRECAUTIONS-Pediatric Use). Pokud dojde k podráždění, je třeba lokální kortikosteroidy vysadit a zahájit vhodnou léčbu.
Stejně jako u všech lokálních kortikosteroidních přípravků může dlouhodobé používání způsobit atrofii kůže a podkožních tkání. Při použití na intertriginózních nebo flexorových oblastech nebo na obličeji k tomu může dojít i při krátkodobém používání.
Při výskytu dermatologických infekcí je třeba zahájit používání vhodného antimykotika nebo antibakteriálního přípravku. Pokud se příznivá odpověď nedostaví okamžitě, je třeba kortikosteroid vysadit, dokud nebude infekce dostatečně zvládnuta.
Informace pro pacienta
Pacienti používající lokální kortikosteroidy by měli obdržet následující informace a pokyny:
- Tento přípravek má být používán podle pokynů lékaře. Je určen pouze k zevnímu použití. Vyhněte se kontaktu s očima.
- Pacienti by měli být poučeni, že tento léčivý přípravek nesmí používat na jiné onemocnění, než na které byl předepsán.
- Ošetřovaná oblast kůže by neměla být obvazována nebo jinak zakrývána či zabalována tak, aby byla okluzivní, pokud to neurčí lékař.
- Pacienti by měli hlásit jakékoli známky lokálních nežádoucích reakcí, zejména pod okluzivním obvazem.
- Rodiče dětských pacientů by měli být upozorněni, aby nepoužívali těsně přiléhající plenky nebo plastové kalhoty u dítěte léčeného v oblasti plenek, protože tyto oděvy mohou představovat okluzivní obvaz.
Laboratorní testy
Při hodnocení suprese osy HPA mohou být užitečné následující testy:
Test volného kortizolu v moči
ACTH stimulační test
Karcinogeneze, mutageneze a poškození fertility
Dlouhodobé studie na zvířatech, které by hodnotily karcinogenní potenciál nebo vliv lokálních kortikosteroidů na fertilitu, nebyly provedeny.
Studie ke stanovení mutagenity u prednisolonu a hydrokortizonu ukázaly negativní výsledky.
Těhotenství kategorie C
Kortikosteroidy jsou u laboratorních zvířat obecně teratogenní, pokud jsou podávány systémově v relativně nízkých dávkách. U silnějších kortikosteroidů byla prokázána teratogenita po dermální aplikaci u laboratorních zvířat. Neexistují žádné adekvátní a dobře kontrolované studie teratogenních účinků lokálně aplikovaných kortikosteroidů u těhotných žen. Proto by se lokální kortikosteroidy měly v těhotenství používat pouze v případě, že potenciální přínos ospravedlňuje potenciální riziko pro plod. Léčivé přípravky této třídy by neměly být u těhotných pacientek používány extenzivně, ve velkém množství nebo po delší dobu.
Kojící matky
Není známo, zda by lokální podání kortikosteroidů mohlo vést k dostatečné systémové absorpci, která by vedla k detekovatelnému množství v mateřském mléce. Systémově podávané kortikosteroidy se vylučují do mateřského mléka v množství, které pravděpodobně nemá škodlivý účinek na kojence. Přesto je třeba dbát zvýšené opatrnosti při lokálním podávání kortikosteroidů kojícím ženám.
Podávání v pediatrii
Dětští pacienti mohou vykazovat větší náchylnost k supresi osy HPA vyvolané lokálními kortikosteroidy a ke Cushingovu syndromu než dospělí pacienti z důvodu většího poměru plochy povrchu kůže k tělesné hmotnosti.
U dětí užívajících topické kortikosteroidy byla hlášena suprese osy hypotalamus-hypofýza-nadledviny (HPA), Cushingův syndrom a intrakraniální hypertenze. Mezi projevy suprese nadledvin u dětí patří lineární růstová retardace, opožděný přírůstek hmotnosti, nízké plazmatické hladiny kortizolu a absence odpovědi na stimulaci ACTH. Mezi projevy intrakraniální hypertenze patří vyboulení fontanel, bolesti hlavy a oboustranný edém papily.
Podávání lokálních kortikosteroidů dětem by mělo být omezeno na nejmenší množství slučitelné s účinným terapeutickým režimem. Chronická léčba kortikosteroidy může narušit růst a vývoj dětí.
Nežádoucí účinky
Následující lokální nežádoucí účinky jsou u lokálních kortikosteroidů hlášeny vzácně, ale mohou se vyskytovat častěji při použití okluzivních obvazů. Tyto reakce jsou uvedeny v přibližném sestupném pořadí výskytu:
| Pálení | Periorální dermatitida |
| Svědění | Alergická kontaktní dermatitida |
| Podráždění | Macerace kůže |
| Suchost | Sekundární infekce |
| Follikulitida | Atrofie kůže |
| Hypertrichóza | Strie |
| Akneiformní erupce | Miliárie |
| Hypopigmentace |
Předávkování
Topicky aplikované kortikosteroidy mohou být absorbovány v dostatečném množství, aby vyvolaly systémové účinky (viz PRECAUTIONS).
Dávkování a způsob podání přípravku Lidex
Lidex gel se obvykle nanáší na postižené místo ve formě tenkého filmu dvakrát až čtyřikrát denně v závislosti na závažnosti stavu.
K léčbě psoriázy nebo rekalcitrantních stavů lze použít okluzivní obvazy.
Pokud se objeví infekce, je třeba přerušit používání okluzivních obvazů a zahájit vhodnou antimikrobiální léčbu.
Jak se přípravek Lidex dodává
Lidex® (fluocinonid) gel 0.05% se dodává v
15 g tubě – NDC 99207-507-13
30 g tubě – NDC 99207-507-14
60 g tubě – NDC 99207-507-17
Skladujte při pokojové teplotě 15°-30°C (59°-86°F).
Vyrobeno pro:
MEDICIS, The Dermatology Company®
Scottsdale, AZ 85258
v dubnu 2001
IN-5071/S
| Lidex fluocinonid gel |
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
Etiketář – MEDICIS
Často kladené otázky
- Používá se při vypadávání vlasů?
- Jaká je náhrada za fluocinonid krém?
- Je fluocinonid antimykotický krém?
- Jak dlouho byste měli fluocinonid používat?
- K čemu je fluocinonid krém vhodný?
- Může se fluocinonid použít k léčbě vyrážky způsobené jedovatým břečťanem?
- Je to steroid?
- Je to antibiotikum?
Další informace o přípravku Lidex (fluocinonid lokálně)
- Nežádoucí účinky
- Při těhotenství nebo kojení
- Informace o dávkování
- Lékové interakce
- 8 recenzí
- Generická dostupnost
- Třída léčivých přípravků:
Zdroje pro spotřebitele
- Pokročilá četba
- Lidex Mild (Pokročilá četba)
- Lidex Regular (Pokročilá četba)
.
Odborné zdroje
- Předpisová informace
- Lidex topický roztok (FDA)
- Lidex mast (FDA)
Ostatní značky Vanos, Lidex-E
Související průvodce léčbou
- Atopická dermatitida
- Exém
- Dermatitida
- Poriáza
Vyjádření lékařské odpovědnosti