Nejprve se zaměříme na základy průtokové cytometrie
Co je to průtoková cytometrie?
Průtoková cytometrie je technika používaná k detekci a měření fyzikálních a chemických vlastností populace buněk nebo částic. Při tomto postupu je vzorek obsahující buňky nebo částice suspendován v tekutině a vstříknut do přístroje průtokového cytometru.
Jaký je účel průtokové cytometrie?
Průtoková cytometrie poskytuje dobře zavedenou metodu identifikace buněk v roztoku a nejčastěji se používá k hodnocení periferní krve, kostní dřeně a dalších tělních tekutin. Studie průtokové cytometrie se používají k identifikaci a kvantifikaci imunitních buněk a k charakterizaci hematologických malignit.1 Mohou měřit:
- velikost buňky
- zrnitost buňky
- celkovou DNA
- nově syntetizovanou
- expresi genů DNA
- povrchové receptory
- vnitrobuněčné buňky. proteiny
- přechodný signál
Schopnost provádět tato měření ve velmi rychlém časovém rozpětí je jednou z klíčových výhod průtokové cytometrie. Mohou kvantifikovat až tři až šest vlastností nebo složek, které jsou kvantifikovány v jednom vzorku, buňku po buňce, pro přibližně 10 000 buněk, za méně než jednu minutu.
Průtokové cytometry Přístrojové vybavení a metodika
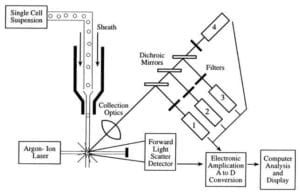 Průtokové cytometry přijímají suspenzi monodisperzních jednotlivých, neshlukovaných buněk a pouštějí je po jedné (single file) kolem laserového paprsku, kde každá buňka prochází laserovým paprskem, rozptýleným a fluorescenčním světlem a poté jsou spočítány a roztříděny nebo dále charakterizovány.
Průtokové cytometry přijímají suspenzi monodisperzních jednotlivých, neshlukovaných buněk a pouštějí je po jedné (single file) kolem laserového paprsku, kde každá buňka prochází laserovým paprskem, rozptýleným a fluorescenčním světlem a poté jsou spočítány a roztříděny nebo dále charakterizovány.
Třemi hlavními součástmi průtokového cytometru jsou fluidní systém, optika a elektronika.
- Fluidní systém průtokového cytometru je zodpovědný za transport vzorků ze zkumavky se vzorky do průtokové buňky, kolem laseru, třídění a/nebo vyřazení.
- Součásti optického systému zahrnují zdroje excitačního světla, čočky a optické filtry používané ke sběru a pohybu vlnových délek světla po přístroji a detekční systém, který generuje fotoproud. Rozdíl vlnových délek v datech pomáhá analyzovat typ buněk.
- Elektronika neboli přístrojové vybavení průtokového cytometru.
Jedním z hlavních principů použití průtokové cytometrie je možnost analyzovat celý buněčný cyklus a analyzovat obsah DNA v různých fázích. Sledování přirozených dějů buněčného cyklu může poskytnout informace pro diagnostiku onemocnění a prognózu terapie. Různé fáze buněčného cyklu mohou odhalit změněný obsah DNA a další anomálie indikující přítomnost nádoru nebo známky pokročilé buněčné smrti. Vyjádření dat se ukládají do počítače prostřednictvím specializovaného softwaru pro průtokovou cytometrii spojeného s použitím zvoleného přístroje v době analýzy. Údaje průtokové cytometrie se obvykle uvádějí dvěma různými způsoby: histogramem a/nebo bodovým grafem2.
| Fáze G1: | RNA, ribozomy a proteiny jsou syntetizovány |
| Fáze S: | DNA je replikována |
| Fáze G2: | Představuje fázi mezi syntézou DNA a mitózou |
| M fáze: | buňky se dělí na dvě dceřiné buňky |
FACS
Fluorescenčně aktivované třídění buněk (FACS) je specializovaný typ průtokové cytometrie. Poskytuje metodu třídění heterogenní směsi biologických buněk do dvou nebo více nádob po jedné buňce na základě specifického rozptylu světla a fluorescenčních vlastností každé buňky. Od průtokové cytometrie se liší tím, že poskytuje jedinečnou charakterizaci oproti pouhému počítání a třídění buněk. Je běžné, že oba principy pracují v procesu typu kocharakterizace, který nabízí kompletní kvalitativní a kvantitativní přístup k průtokové cytometrické analýze.
Průtokový cytometrický proces:
Buněčná suspenze je zachycena ve středu úzkého, rychle proudícího proudu kapaliny. Tok je uspořádán tak, aby mezi buňkami byla velká vzdálenost vzhledem k jejich průměru. Vibrační mechanismus nutí proud buněk, aby se rozpadl na jednotlivé kapičky. Systém je nastaven tak, aby byla malá pravděpodobnost výskytu více než jedné buňky na kapičku. Těsně předtím, než se proud rozpadne na kapičky, prochází proud stanicí pro měření fluorescence, kde se měří fluorescenční charakter každé buňky.
Těsně v místě, kde se proud láme na kapičky, je umístěn elektrický nabíjecí kroužek. Na kroužek se umístí náboj na základě bezprostředně předcházejícího měření intenzity fluorescence a opačný náboj se zachytí na kapce, když se odlomí z proudu. Nabité kapky pak propadnou elektrostatickým vychylovacím systémem, který na základě jejich náboje rozdělí kapky do nádob. V některých systémech je náboj aplikován přímo na proud a kapka, která se odtrhne, si zachová náboj stejného znaménka jako proud. Po odlomení kapky je proud opět neutrální.
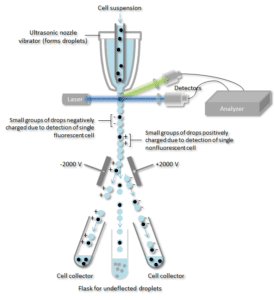
Protilátka specifická pro určitý povrchový protein buňky je spojena s fluorescenční molekulou a poté přidána do směsi buněk. Dalším krokem je proces fluorescence, přičemž specifické buňky procházejí laserovým paprskem, kterým jsou sledovány. Kapkám obsahujícím jednu buňku je přiřazen kladný nebo záporný náboj podle toho, zda má buňka fluorescenčně značenou protilátku. Kapky obsahující jednu buňku jsou pak detekovány elektrickým polem a podle svého náboje odkloněny do samostatných sběrných zkumavek, což umožňuje snadné oddělení buněk označených fluorescenční protilátkou.
Vícebarevná průtoková cytometrie
Vícebarevná průtoková cytometrie je užitečná technika při zkoumání smíšených populací buněk, jako jsou krevní a tkáňové buňky v lidských a zvířecích vzorcích. Obecně je specifický typ buněk označen fluorescenčním barvivem (markerem), jako je fluorofor nebo propidium jodid. Možnost použití více fluorescenčních markerů současně umožňuje identifikovat více typů buněk a také funkční markery, které dále charakterizují každý vzorek. Existují specializované přístroje schopné měřit více než 12 barev 3,4 . Tato fluorescenční barviva a markery se měří pomocí různých vlnových délek světla vyzařovaného laserem, což umožňuje třídění podle jednotlivých typů buněk. Každý marker je excitován při specifické vlnové délce světla, aby bylo možné je rozlišit při použití více markerů.
Přizpůsobení typického barvicího panelu ze 4 až 6 barev na více než 12 barev není jednoduše záležitostí „plug and play“, musí se k němu přistupovat systematicky, aby se dosáhlo úspěšných parametrů barvicího panelu. Základní principy návrhu panelu fungují nejlépe na základě průzkumu před použitím. Jinými slovy, příprava je klíčová již od počátečního procesu odkazování na index barvení, pokud jde o účinné sladění fluorochromů podle jasu5.
Tip pro průtokovou cytometrii:
Před návrhem panelu primárních protilátek věnujte nějaký čas pochopení jemných nuancí svého průtokového cytometru. Zaměřte se na to, kde lze na systému provádět nejcitlivější měření. Jde o víc než jen o intenzitu fluorescence.
Zvažte záměnu za méně jasný fluorochrom, abyste se vyhnuli chybám v kanálech.
Obvyklé aplikace metodiky průtokové cytometrie
Průtoková cytometrie je nedílnou součástí v několika klinických oblastech, včetně diagnostiky, plánů léčby a systémových onemocnění, ať už statických nebo progresivních. S tím, jak se dozvídáme více o praktických aplikacích pro využití průtokové cytometrie, se znalostní základna dále rozšiřuje. Vědci jsou nyní více než kdy dříve velmi nadšeni z toho, že se mohou dozvědět více o složitosti některých onemocnění a stavů. To vedlo k rychlým změnám v diagnostice vzorových a drasticky změněných lékařských přístupů k léčbě nemocí, jako je rakovina6.
Metodika průtokové cytometrie je často zapojena do dalších komplexních testovacích vzorců, jako je morfologické vyšetření. V mnoha případech hematologické novotvary zobrazují specifické morfologické změny a průtoková cytometrie poskytuje větší specifičnost a pomáhá patologům rozšířit tkáňové anomálie nebo jiná pokročilá onemocnění. Průtoková cytometrie může v některých případech předurčit recidivu nádorového onemocnění ještě před zjištěním morfologických změn7.
Několik hlavních aplikací používaných v rámci moderního klinického prostředí, a to jak terapeutického, tak výzkumného zaměření, zahrnuje např:
- Exprese proteinů – v celé buňce, dokonce i v jádře
- Potranslační modifikace proteinů – zahrnuje štěpené a fosforylované proteiny
- RNA – zahrnuje jak miRNA, i transkripty mRNA
- Stav buněk-detekce apoptotických buněk nebo buněčné smrti
- Stav buněčného cyklu-poskytuje účinný nástroj k posouzení buněk ve fázi G0/G1 oproti fázi S, G2 nebo polyploidii, včetně analýzy buněčné proliferace a aktivace
- Identifikace a charakterizace odlišných podskupin buněk v heterogenním vzorku – včetně rozlišení centrálních efektorových paměťových buněk od vyčerpaných T-buněk nebo regulačních T-buněk
Závěr
Základní principy průtokové cytometrie se za poslední desetiletí změnily jen málo, ale aplikace této technologie prošly velkým vývojem. Základy průtokové cytometrie byly konzistentní s její primární funkcí, kterou je dotazování jednotlivých buněk nebo částic v proudu pomocí laseru, když se buňky pohybují kolem sady stacionárních detektorů. Stále více barev fluorescence je detekováno cytometry spolu s vysokorychlostním tříděním a analytickou funkcí8.
Průtoková cytometrie hraje nedílnou roli ve výzkumu molekulárních věd a nadále se rychle vyvíjí. Na trhu je několik komerčních průtokových cytometrů. Většinou fungují na stejném základním principu, ale existují významné rozdíly v jejich konstrukci a koncepcích seřazení a integrace dalších komponent.
Brzy bude na obzoru 3D instrumentace, která bude začleněna do hybridního patentovaného přístroje vyráběného společností NanoCellect Biomedical, WOLF Cell Sorter. Můžeme se také těšit na vývoj fluorescenčních sond s úzkým spektrem, integraci molekulárně biologických technik s průtokovou cytometrií a vyhodnocování bezbuněčných markerů, jako jsou cytokiny, budou klíčovými součástmi v pokračujícím vývoji analýzy průtokovou cytometrií a technologie buněčných testů.
Zdroje:
1 http://clinchem.aaccjnls.org/content/46/8/1221
2 https://pubmed.ncbi.nlm.nih.gov/18615596-flow-cytometry-histograms-transformations-resolution-and-display/
3 https://onlinelibrary.wiley.com/doi/full/10.1002/cyto.a.20959
4 https://currentprotocols.onlinelibrary.wiley.com/doi/abs/10.1002/cpim.26
5 https://www.nature.com/articles/nprot.2006.250
6 https://pubmed.ncbi.nlm.nih.gov/19967915-immunophenotypic-analysis-of-bone-marrow-b-lymphocyte-precursors-hematogones-by-flow-cytometry/
7 https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4803461/
8 https://link.springer.com/protocol/10.1385/0-89603-150-0:543