Použití a význam článků a baterií jsou nezpochybnitelné. V našem každodenním životě využíváme články mnoha různými způsoby. Nyní jsme vás již v několika minulých pojmech seznámili s bateriemi obecně. Zde vám však poskytneme podrobný rozbor galvanických článků. Pojďme tedy začít.
Navržená videa
Galvanické články
Galvanický článek je mimo jiné typ elektrochemického článku. Používá se k dodávání elektrického proudu uskutečňováním přenosu elektronů prostřednictvím redoxní reakce. Galvanický článek je příkladnou představou toho, jak lze využít energii pomocí jednoduchých reakcí mezi několika danými prvky. Je úžasné studovat, jak lze galvanický článek sestavit a využít k získání energie.
Vysvětleno nejjednodušeji, galvanický článek funguje jako zařízení, ve kterém probíhají současně oxidační a redukční reakce. Tyto reakce slouží k přeměně chemické energie na energii elektrickou, kterou lze využít k jakýmkoli komerčním účelům.
Prohlédněte si další témata z oblasti elektrochemie
- Baterie
- Vodivost elektrolytických roztoků
- Koroze
- Elektrochemické články
- Elektrolytické články a elektrolýza
- Palivové články
- Nernstova rovnice
- Změna vodivosti a molární vodivosti s koncentrací
.
Pracování galvanických článků

Pracování galvanického článku je poměrně jednoduché. Zahrnuje chemickou reakci, díky níž je jako konečný výsledek k dispozici elektrická energie. Během redoxní reakce využívá galvanický článek přenosu energie mezi elektrony k přeměně chemické energie na energii elektrickou.
Galvanický článek využívá schopnosti oddělit tok elektronů v procesu oxidace a redukce, způsobit poloviční reakci a spojit každou z nich s vodičem tak, aby mohla vzniknout cesta pro tok elektronů takovým vodičem. Tento tok elektronů se v podstatě nazývá proud. Takový proud lze přimět k tomu, aby protékal vodičem, a uzavřít tak obvod a získat jeho výstup v jakémkoli zařízení, například v televizoru nebo hodinkách.
Galvanický článek lze vyrobit z libovolných dvou kovů. Tyto dva kovy mohou tvořit anodu a katodu, pokud zůstanou ve vzájemném kontaktu. Tato kombinace umožňuje galvanickou korozi toho kovu, který je více anodický. K tomu, aby tato koroze mohla probíhat, je zapotřebí spojovací obvod.
Nastavení galvanického článku
K vytvoření galvanického článku by bylo třeba projít následujícím nastavením. V ideálním případě by článek obsahoval dvě elektrody. Jedna z těchto elektrod, katoda, by měla být kladně nabitá elektroda, zatímco druhá by měla být anoda, záporně nabitá elektroda.
Tyto dvě elektrody by měly tvořit dvě základní součásti galvanického článku. Chemická reakce související s redukcí probíhá na katodě, zatímco oxidační poloreakce probíhá na anodě. Jak již bylo řečeno, k vytvoření chemické reakce lze použít libovolné dva kovy.
Pochopení galvanického článku na příkladu
Uveďme si příklad, kdy dvěma kovy zapojenými do chemické reakce jsou zinek a měď. Při chemické reakci by zinek nakonec ztratil dva elektrony. Ty převezme měď a stane se z ní elementární měď. Protože tyto dva kovy budou umístěny ve dvou oddělených nádobách a byly by spojeny vodivým drátem, vznikl by elektrický proud, který by přenesl všechny elektrony z jednoho kovu na druhý.
Současně budou oba kovy ponořeny do roztoku soli, v tomto případě řekněme síranu zinečnatého a síranu měďnatého. V tomto případě se oba roztoky nemíchají přímo, ale lze je spojit pomocí můstku nebo média. Toto médium bude zodpovědné za přenos iontů, ale také zajistí, aby se oba roztoky navzájem nemíchaly.
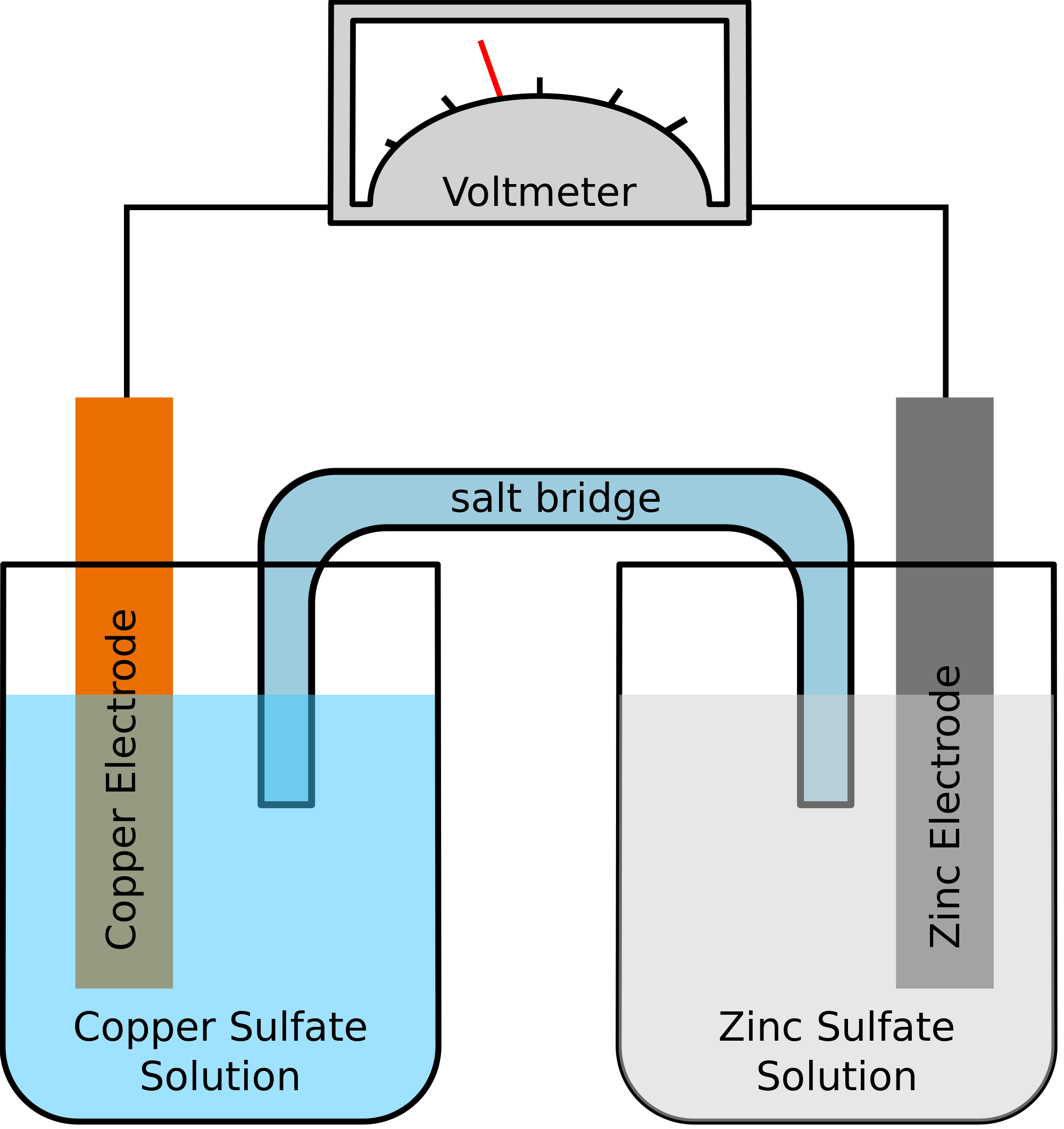
Takový můstek pomáhá uzavřít obvod pro přenos elektrického náboje a také zajistí, aby roztoky v nádobách s kovy zůstaly neutrální a vzájemně se nemíchaly. Pokud solný můstek nezasahuje do redoxní reakce, při níž probíhá oxidace a redukce, nezáleží na tom, který solný můstek se při chemické reakci používá.
Několik důležitých pojmů
Níže jsou uvedeny některé důležité pojmy, které se v galvanických článcích používají:
- Hranice fází:
- Solný můstek: Označuje dva kovy, které fungují jako katoda a anoda: Spojovací můstek nebo médium, které umožňuje, aby probíhala redoxní reakce.
- Oxidace a redukce:
Řešené příklady pro vás
Otázka: Jaké jsou chemické procesy, které umožňují vznik a průchod elektrického proudu galvanickým článkem? Co by se stalo, kdyby se v galvanickém článku nepoužil solný můstek, zatímco by probíhala redoxní reakce?
Řešení: V případě, že by v každé nádobě obsahující kovy nebyl použit solný můstek, redoxní reakce by probíhala stejně. V případě nepřítomnosti solného můstku by však stejná reakce skončila poměrně náhle. Příslušné roztoky by nebyly schopny udržet svou elektrickou neutralitu. Kromě toho nedojde k žádné změně chemické reakce ani k žádné změně jakéhokoli typu v důsledku nepřítomnosti solného můstku nebo média.