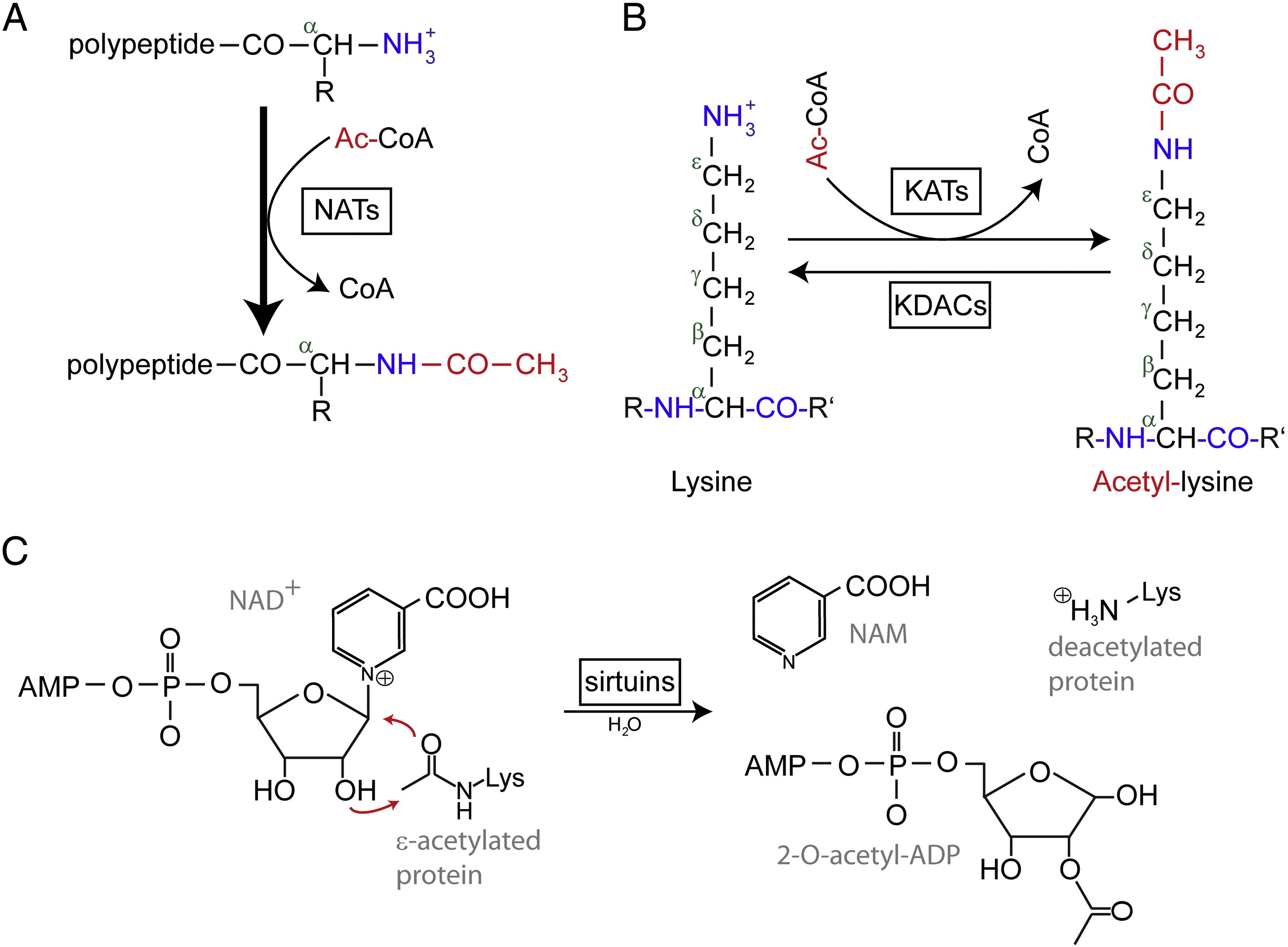
Acetylace označuje reakci, při níž se do chemické sloučeniny zavádí acetylové funkční skupiny, přičemž atom vodíku hydroxylové skupiny je nahrazen acetylovou skupinou (CH3 CO) za vzniku specifického esteru, acetátu. Acetylace bílkovin má běžně dvě různé formy. U lidí se téměř (80-90 %) bílkovin ko-translačně acetyluje na Nα-koncích vznikajících polypeptidových řetězců. Jiný typ je typicky acetylován na lyzinových zbytcích.
N-terminální acetylace
N-terminální (Nt) acetylace jsou katalyzovány Nt-acetyltransferázami (NAT) a zatím je zjištěno, že jsou nevratné. NAT, jedno- nebo vícesložkové enzymy sestávající z katalytické podjednotky a až dvou pomocných podjednotek, mohou přenášet acetylovou skupinu z acetylkoenzymu A (Ac-CoA) na α-aminoskupinu prvního aminokyselinového zbytku proteinu. U NAT moduluje hlavní pomocná podjednotka aktivitu a substrátovou specifitu katalytické podjednotky. Za acetylaci Nt jsou zodpovědné různé NAT. U lidí bylo dosud nalezeno šest NAT, včetně NatA, NatB, NatC, NatD, NatE a NatF. Kromě rozdílů ve složení podjednotek se jednotlivé NAT liší i svou substrátovou specifitou.
Acetylace Nt hraje v molekulárních účincích různou roli. Za prvé, Nt-acetylace určuje subcelulární lokalizaci pro určité proteiny. Například Arl3 a Grh1, dva proteiny asociované s Golgiho aparátem, se nemohou asociovat s Golgiho aparátem, pokud jim chybí Nt-acetylová skupina. Za druhé se uvádí, že Nt-acetylace zadržuje proteiny v cytosolu a inhibuje posttranslační translokační migraci do endoplazmatického retikula (ER) a sekreční dráhy. Kromě toho může Nt acetylace měnit vlastnosti N-konce, čímž dochází k modulaci interakcí protein-protein. U několika proteinů bylo prokázáno, že po Nt-acetylaci se zvyšuje afinita k jejich vazebným partnerům. Například ubikvitin-konjugující enzym E2 Ubc12 prochází Nt-acetylací NatC, která umožňuje zvýšení afinity k jeho interakčnímu partnerovi, E3 ubikvitin ligáze Dcn1. Kromě toho Nt-acetylace kontroluje kvalitu a životnost proteinů a reguluje stechiometrii proteinů cestou N-end rule.
N-terminální acetylace má mnoho funkcí ve fyziologii. NAT jsou nezbytné pro normální vývoj, vývoj kostí a cév. N-terminální acetylace může regulovat krevní tlak, lokalizaci proteazomu, hormony a také strukturu a funkci organel. U lidských onemocnění souvisí s neurodegenerativními chorobami (jako je Alzheimerova choroba, Parkinsonova choroba a demence s Lewyho tělísky) a rakovinou (jako je rakovina plic, prsu a tlustého střeva).
Acetylace lysinu
Acetylované zbytky lysinu byly poprvé objeveny v histonech regulujících transkripci genů. Acetylace lysinu se však neomezuje pouze na histony. Na rozdíl od acetylace Nt je acetylace lysinu reverzibilní. Acetylaci katalyzují lysinacetyltransferázy (KAT) a deacetylaci lysinových zbytků katalyzují lysindeacetylázy (KDAC).
Uvádí se, že v lidském genomu bylo identifikováno 17-22 genů KAT (Přesný počet KAT je sporný), které lze rozdělit do tří různých rodin, včetně rodiny GCN5 (general control non-derepressible 5) – příbuzné acetyltransferázy (GNAT), rodiny MYST a rodiny p300/CBP (CREB-binding protein). Mezi známé substráty komplexů KAT patří nejen histonové proteiny, ale i některé různé transkripční faktory, transkripční koregulátory a některé proteiny specifických buněčných signálních drah, jako je p53, β-katenin, NF-κB, MyoD nebo Rb. A dokonce i některé molekuly RNA mohou být acetylovány. Existují čtyři různé typy KDAC, včetně třídy I, II, III a IV. Třídy I, II a IV jsou Zn2+ dependentní amidohydrolázy, zatímco třída III (nazývaná také sirtuiny) využívá jako ko-substrát pro svou katalytickou aktivitu NAD+ jsou Zn2+ dependentní amidohydrolázy.
Histony jsou prvními objevenými acetylovanými proteiny. Molekuly histonů jsou modifikovány různými PTM, včetně fosforylace, metylace a acetylace. acetylace histonů, určuje sestavení histonů a také skládání a kompaktnost interakce DNA-histon, a představuje tak přepínač mezi permisivní a represivní strukturou chromatinu. Kromě histonů mohou KAT katalyzovat i cytoskeletální proteiny. Existují některá nově identifikovaná místa acetylace v dalších proteinech, včetně proteinů HMG, c-Myc, estrogenových a androgenních receptorů, E2F/Rb atd.
Byly popsány fyziologické role acetylace lysinu. Histonové proteiny jsou spojeny s těsnou regulací v podstatě všech typů DNA-templovaných procesů jako transkripce, replikace, rekombinace, opravy, ale i translace a tvorby specializovaných chromatinových struktur. Acetylace lysinu v proteinech proto ovlivňuje řadu buněčných signálních drah, stejně jako metabolismus, reakce na stres, apoptózu a membránový obchod.
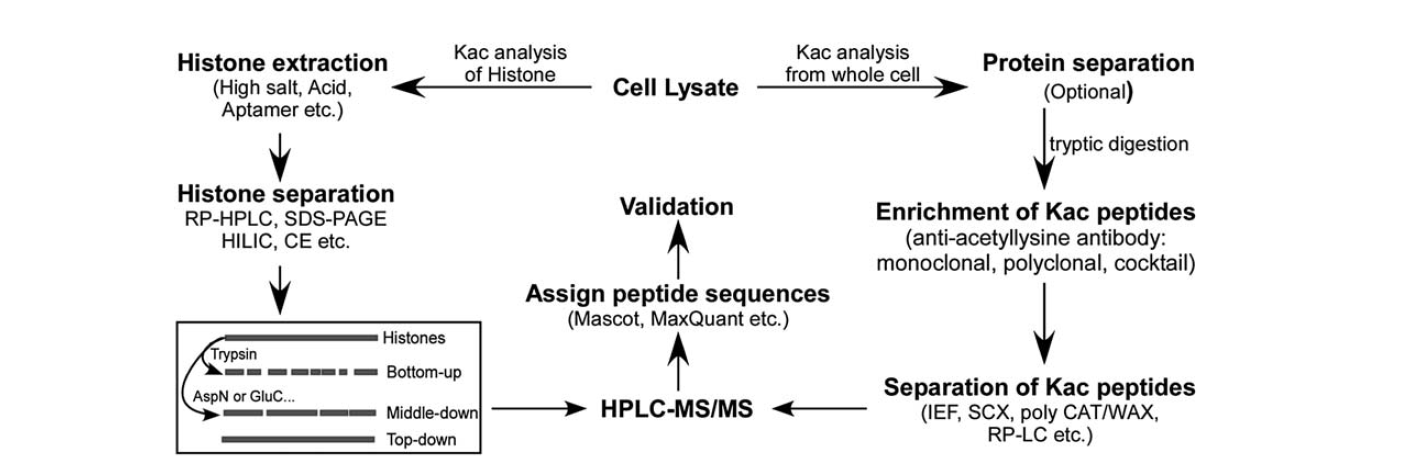
Pro identifikaci acetylace lysinu je k dispozici poměrně málo nástrojů. S rozvojem hmotnostní spektrometrie se stala důležitým nástrojem pro identifikaci a kvantifikaci acetylace lysinu. K analýze acetylace histonového lysinu je třeba několika kroků, včetně buněčného lyzátu, extrakce histonů, separace histonů, hmotnostní spektrometrie a analýzy dat. Analýza lysinové acetylace proteinů z celé buňky zahrnuje kroky: buněčný lyzát, separace proteinů, obohacení peptidů lysinové acetylace, separace peptidů lysinové acetylace, hmotnostní spektrometrie a analýza dat.
.