
Při probublávání plynného chloru válcem s rajčatovou šťávou se směs chloru a rajčatové šťávy během pěti minut téměř úplně zbarví do běla. Tato efektní změna je důsledkem chemického působení chloru, který působí jako oxidační bělicí činidlo, na pigmenty v rajčatové šťávě. Když se staré novinové výstřižky, které stárnutím a působením světla ztratily barvu, ošetří 1 % vodným roztokem borohydridu sodného, papír během dvaceti minut dramaticky vybělí. V tomto případě byla papíru navrácena původní bílá barva působením borohydridu sodného, který působí jako redukční bělicí činidlo.
Bělící činidlo je látka, která může bělit nebo odbarvovat jiné látky. Barevné látky obvykle obsahují skupiny atomů, nazývané chromofory , které mohou absorbovat viditelné světlo o specifických, charakteristických vlnových délkách a odrážet nebo propouštět tu část světla, která není absorbována. Například pokud chromofor absorbuje modré světlo, odráží světlo komplementární barvy a látka obsahující chromofor se jeví jako žlutá. Bělící činidla v podstatě ničí chromofory (a tím odstraňují barvu) prostřednictvím oxidace nebo redukce těchto absorpčních skupin. Bělidla lze tedy klasifikovat buď jako oxidační, nebo redukční činidla .
Některá použití bělicích činidel jsou následující:
- Bělení textilií a tkanin
- Bělení dřevní hmoty
- Odstraňování skvrn
- Praní a čištění v obchodě a domácnosti
- . Jako složky čisticích prostředků a prostředků na mytí nádobí
- Bělení vlasů
Oxidační bělidla
Velké množství oxidačních bělidel revidoval Jules A. Szilard v knize Bleaching Agents and Techniques (1973). Oxidační bělidla (a bělicí prostředky), která se dnes běžně používají, jsou: chlor, oxid chloričitý, alkalické chlornany, peroxid vodíku, peroxidové sloučeniny a sluneční a umělé světlo.
Chlor (Cl 2 ). Objev chloru švédským chemikem Carlem Wilhelmem Scheelem v roce 1774 znamenal začátek moderní éry bělení. Podle Sidneyho M. Edelsteina v časopiseckém článku „The Role of Chemistry in the Development of Dyeing and Bleaching“ z roku 1948 francouzský chemik Claude-Louis Berthollet jako první použil chlór k bělení bavlněných a lněných tkanin.
Chlór byl používán k bělení dřevní hmoty. Mnoho celulózek využívajících Kraftův proces rozvlákňování připravuje hydroxid sodný (potřebný k rozkladu dřevní štěpky) přímo na místě elektrolýzou solanky , koncentrovaného vodného roztoku chloridu sodného.
2NaCl + 2H 2 O → 2NaOH + H 2 + Cl 2 (1)
Chlór je vedlejší produkt. Následným bělením hnědé buničiny chlorem vzniká produkt, který lze použít k výrobě psacího a tiskařského papíru. Organické sloučeniny v buničině jsou bohužel oxidovány i chlorovány, čímž vzniká malé množství organochlorových sloučenin, včetně
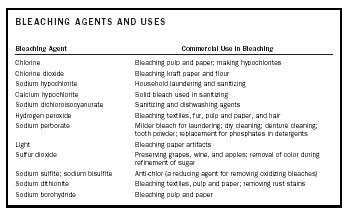
| BĚLICÍ PROSTŘEDKY A JEJICH POUŽITÍ | |
| Bělící prostředek | Komerční použití při bělení |
| Chlor | Bělení buničiny a papíru; výroba chlornanů |
| Oxid chloričitý | Bělení kraftového papíru a mouky |
| Chlornan sodný | Praní a dezinfekce v domácnosti |
| Vápník chlornan | Tuhé bělidlo používané při dezinfekci |
| Dichlorisokyanurát sodný | Prostředky na dezinfekci a mytí nádobí |
| Peroxid vodíku | Bělení textilií, kožešiny, celulózu a papír a vlasy |
| Perboritan sodný | Mírnější bělidlo pro praní; chemické čištění; čištění zubních protéz; zubní prášek; náhrada fosfátů v pracích prostředcích |
| Světlo | Bělení papírových artefaktů |
| Oxid siřičitý | Konzervování hroznů, vína a jablek; odstraňování barvy při rafinaci cukru |
| Siřičitan sodný; disiřičitan sodný | Antichlor (redukční činidlo pro odstranění oxidačních bělidel) |
| Dithionit sodný | Bělení textilií, celulózy a papíru; odstraňování skvrn od rzi |
| Borohydrid sodný | Bělení buničiny a papíru |
dioxiny. Ve skutečnosti bylo zjištěno, že nejrozšířenější dioxin vznikající při výrobě buničiny a bělení, 2,3,7,8-tetrachlorodibenzo- p -dioxin (2,3,7,8-TCDD), je jak karcinogen, tak smrtící toxin . Proto se chlor jako bělicí činidlo nahrazuje bezpečnějšími bělicími činidly oxidem chloričitým a peroxidem vodíku. Ve skutečnosti je trendem v celulózovém a papírenském průmyslu bělení zcela bez chlóru (TCF). Chlor se nyní v bělicím průmyslu používá hlavně k přípravě roztoků chlornanu a suchých bělidel, jako je chlornan vápenatý.
Oxid chloričitý (ClO 2 ). Oxid chloričitý se používá jako bělicí činidlo jak v plynné fázi, tak ve vodném roztoku. Vzhledem ke své výbušnosti se oxid chloričitý v plynné fázi často ředí dusíkem nebo oxidem uhličitým. Pokud je oxid chloričitý skladován nebo přepravován, prochází studenou vodou a uchovává se v chladu.
Oxid chloričitý se průmyslově připravuje redukcí chlorečnanu sodného oxidem siřičitým ve vodném roztoku.
2NaClO 3 + SO 2 + H 2 SO 4 → 2ClO 2 + 2NaHSO 4 (2)
Relativně bezpečná metoda přípravy ClO 2 zahrnuje reakci mezi chloritanem sodným (NaClO 2 ) a formaldehydem (H 2 CO).
H 2 CO + H + + ClO 2 – → HOCl + HCOOH (3)
Při průběhu reakce 3 klesá pH roztoku (v důsledku tvorby kyseliny mravenčí ). Zvýšená kyselost roztoku podporuje tvorbu ClO 2 , jak ukazuje rovnice 4.
HCOOH + HOCl + 2ClO 2 – → 2ClO 2 + Cl – + H 2 O + HCOO – (4)
V kyselém roztoku se oxid chloričitý chová jako oxidační činidlo. Úplná redukce ClO 2 je znázorněna v rovnici 5.
ClO 2 + 4H + + 5 e – → Cl – + 2H 2 O (5)
V jednotlivých krocích této celkové redukční reakce vznikají HClO 2 , HOCl a Cl 2 , které se chovají jako oxidační činidla. Je nutné kyselé prostředí, protože ClO 2 v alkalickém roztoku disproporcionuje, jak ukazuje rovnice 6.
2ClO 2 + 2OH – → ClO 3 – + ClO 2 – + H 2 O (6)
Oxid chloričitý se používá především k bělení celulózy.
Chloritany (OCl – ). Roztoky chlornanů pro bělení se vyrábějí z NaOCl a v menší míře z Ca(OCl) 2 . Chlornany se používají při praní prádla, jako dezinfekční prostředky, při bělení buničiny a textilií a při odstraňování inkoustu z recyklovaného papíru. Komerční bělicí roztoky se získávají průchodem plynného chloru studeným, zředěným vodným hydroxidem sodným, jak je uvedeno v rovnici 7.
Cl 2 + 2OH – → OCl – + Cl – + H 2 O (7)
Alternativně může chlornanový iont vznikat hydrolýzou organických sloučenin dusíku a chloru. Některé z významnějších dusík-chlorových sloučenin používaných tímto způsobem jsou chlorované isokyanuráty. Ty se používají v čisticích prostředcích a myčkách nádobí.
Aby byl roztok chlornanu účinným bělidlem, měl by být udržován zásaditý (pH > 9,0), aby se potlačila hydrolýza OCl – (viz rovnice 8) a zabránilo se vzniku nestabilního HOCl.
OCl – + H 2 O → HOCl + OH – (8)
V kyselých roztocích se tvoří a rozkládá HOCl.
3HOCl → HClO 3 + 2HCl (9)
HOCl bude také reagovat s HCl, jedním z produktů rozkladu.
HOCl + HCl → H 2 O + Cl 2 (10)
Roztoky chlornanu bělícího nesmí obsahovat kationty těžkých kovů, protože tyto kationty (stejně jako světlo nebo teplo) podporují rozklad HOCl, jak je uvedeno v rovnici č. 11.
2HOCl → 2HCl + O 2 (11)
Účinné látky v chlornanových bělidlech se mění v závislosti na pH. Při pH < 2 je hlavní složkou v roztoku Cl 2; při pH 4 až 6 je dominantní HOCl; při pH > 9 je přítomna pouze OCl -. Právě chlornanový ion v základním roztoku je účinnou složkou bělidel pro domácnost, která obvykle obsahují asi 5 až 6 % NaOCl. Iont OCl – oxiduje chromofory v barevných materiálech a sám se redukuje na chloridové a hydroxidové ionty.
OCl – + H 2 O + 2 e – → Cl – + 2OH – (12)
Proces bělení prováděný komerčním chlornanovým bělidlem je často zesílen použitím optických zjasňovačů, sloučenin, které absorbují dopadající ultrafialové světlo a vyzařují viditelné světlo, takže látka vypadá jasnější a bělejší.
Peroxid vodíku (H 2 O 2 ) . Peroxid vodíku lze připravit reakcí peroxidu barnatého a kyseliny sírové (viz rovnice 13). Protože se síran barnatý vysráží, peroxid vodíku se snadno oddělí.
BaO 2 + H 2 SO 4 → BaSO 4 + H 2 O 2 (13)
Peroxid vodíku jako bělicí činidlo používané v celulózovém a papírenském průmyslu má tu výhodu, že neznečišťuje životní prostředí. Vzhledem k nestabilitě čistého peroxidu vodíku se při bělení používají vodné roztoky. Při pokojové teplotě se peroxid vodíku velmi pomalu rozkládá na vodu a kyslík.
2H 2 O 2 → H 2 O + O 2 (14)
Přítomnost kationtů přechodných kovů (zejména Fe 3+ , Mn 2+ a Cu 2+ ) a dalších katalyzátorů však tuto reakci výrazně urychluje. V důsledku toho musí být vodný peroxid vodíku stabilizován komplexotvornými činidly, která sekvestrují kationty přechodných kovů.
Aktivní bělicí formou v peroxidu vodíku je perhydroxylový aniont , OOH – , vznikající ionizací H 2 O 2 .
H 2 O 2 + H 2 O → H 3 O + + OOH – (15)
Kyselá ionizační konstanta peroxidu vodíku je velmi nízká ( K a = 2 × 10 -12 ), což má za následek, že roztoky H 2 O 2 musí být alkalické, aby

ke zvýšení koncentrace OOH – . Při absenci alkalického prostředí již peroxid vodíku není jako bělicí prostředek účinný. Například ve fázi bělení při barvení vlasů se často používá peroxid vodíku (5-6 %), ale také amoniak k zajištění alkalického prostředí.
Současně nesmí pH stoupnout nad 11, protože v tomto okamžiku začíná docházet k rozkladu OOH -.
2OOH – → O 2 + 2OH – (16)
Peroxidové sloučeniny. Existuje řada pevných peroxidových sloučenin, které při rozpuštění ve vodě uvolňují peroxid vodíku. Patří mezi ně perboritan sodný (NaBO 3 z 4H 2 O nebo NaBO 2 z H 2 O 2 z 3H 2 O) a peroxyhydrát uhličitanu sodného (2Na 2 CO 3 z 3H 2 O 2 ). Struktura perboritanu sodného obsahuje peroxoaniont B 2 (O 2 ) 2 (OH) 4 2- , který obsahuje dvě O-O vazby, které spojují dvě tetraedrické skupiny BO 2 (OH) 2- . Tyto peroxosloučeniny se používají v detergentech, čisticích prostředcích na zubní náhrady a zubních prášcích.
Bělení světlem. Bělení, které zahrnuje buď přirozené sluneční světlo, nebo umělé světlo, se používá k odstraňování skvrn z papírových artefaktů a k úpravě textilií. Materiál, který se má bělit, se nejprve ponoří do alkalického roztoku hydrogenuhličitanu vápenatého nebo hořečnatého a poté se chrání před ultrafialovým zářením zakrytím plexisklem, lexanem nebo mylarem. Poté se vystaví světlu na dvě až čtyři hodiny v případě přirozeného slunečního světla a na dvě až dvanáct hodin v případě umělého světla.
Redukční bělidla
Mezi redukční činidla používaná při bělení patří siřičitany, disiřičitany, dithionitany a borohydrid sodný, které se používají při bělení celulózy a textilu.
Siřičitany (SO 3 2- ) a disiřičitany (HSO 3 – ). Oxidační stav síry v SO 3 2- i HSO 3 – je +4 a snadno dochází k oxidaci na +6 za vzniku SO 4 2- , respektive HSO 4 – , což ze siřičitanů a disiřičitanů činí dobrá redukční činidla.
Dithionity (S 2 O 4 2- ) . Dithionit sodný i zinečnatý našly uplatnění při bělení mechanické buničiny a textilií. Příprava dithionitového iontu se provádí redukcí disiřičitanového iontu a oxidu siřičitého prachem Zn.
2HSO 3 – + SO 2 + Zn → Zn 2+ + S 2 O 4 2- + SO 3 2- + H 2 O (17)
Dithionitový ion, S 2 O 4 2- , který má síru v oxidačním stavu +3, se v alkalickém roztoku chová jako silné redukční činidlo.
S 2 O 4 2- + 4OH – → 2SO 3 2- 2H 2 O + 2 e – (18)
Se snižováním pH redukční schopnost dithionitového iontu klesá, jak předpokládá LeChatelierův princip.
Dithionity jsou užitečné při odstraňování skvrn od rzi a neutrální citrátové roztoky Na 2 S 2 O 4 byly použity k odstranění korozních produktů železa z předmětů vyzvednutých z Titaniku.
Borohydrid sodný (NaBH 4 ). Borohydrid sodný se používal zejména při průmyslovém bělení mechanické buničiny. BH 4 – ion je silným redukčním činidlem v alkalickém roztoku.
BH 4 – + 10OH – → BO 3 3- + 8 e – + 7H 2 O (19)
Jedním z problémů při použití borohydridu sodného je, že se BH 4 – ion ve vodném roztoku pomalu rozkládá.
BH 4 – + 4H 2 O → B(OH) 4 – + 4H 2 (20)
Jako alternativní metoda mohou být soli BH 4 – rozpuštěny v CH 3 OH nebo v méně toxickém C 2 H 5 OH. Rozklad BH 4 – iontu v alkoholech probíhá mnohem pomaleji:
BH 4 – + 4ROH → B(OR) 4 – + 4H 2 (R = CH 3 , C 2 H 5 ) (21)
Závěr
Bělidlo může látku vybělit nebo odbarvit reakcí s chromofory, které jsou zodpovědné za barvu látky. V závislosti na povaze chromoforů bude bělicí činidlo buď oxidačním, nebo redukčním činidlem. To znamená, že chromofor je buď oxidován, nebo redukován za vzniku bezbarvé nebo vybělené látky. Bělící činidla a jejich komerční použití jsou shrnuty v tabulce 1.