Trend 2: U oxokyselin s daným centrálním atomem roste kyselost s oxidačním stavem centrálního prvku nebo jinými slovy s počtem kyslíků vázaných na centrální atom.
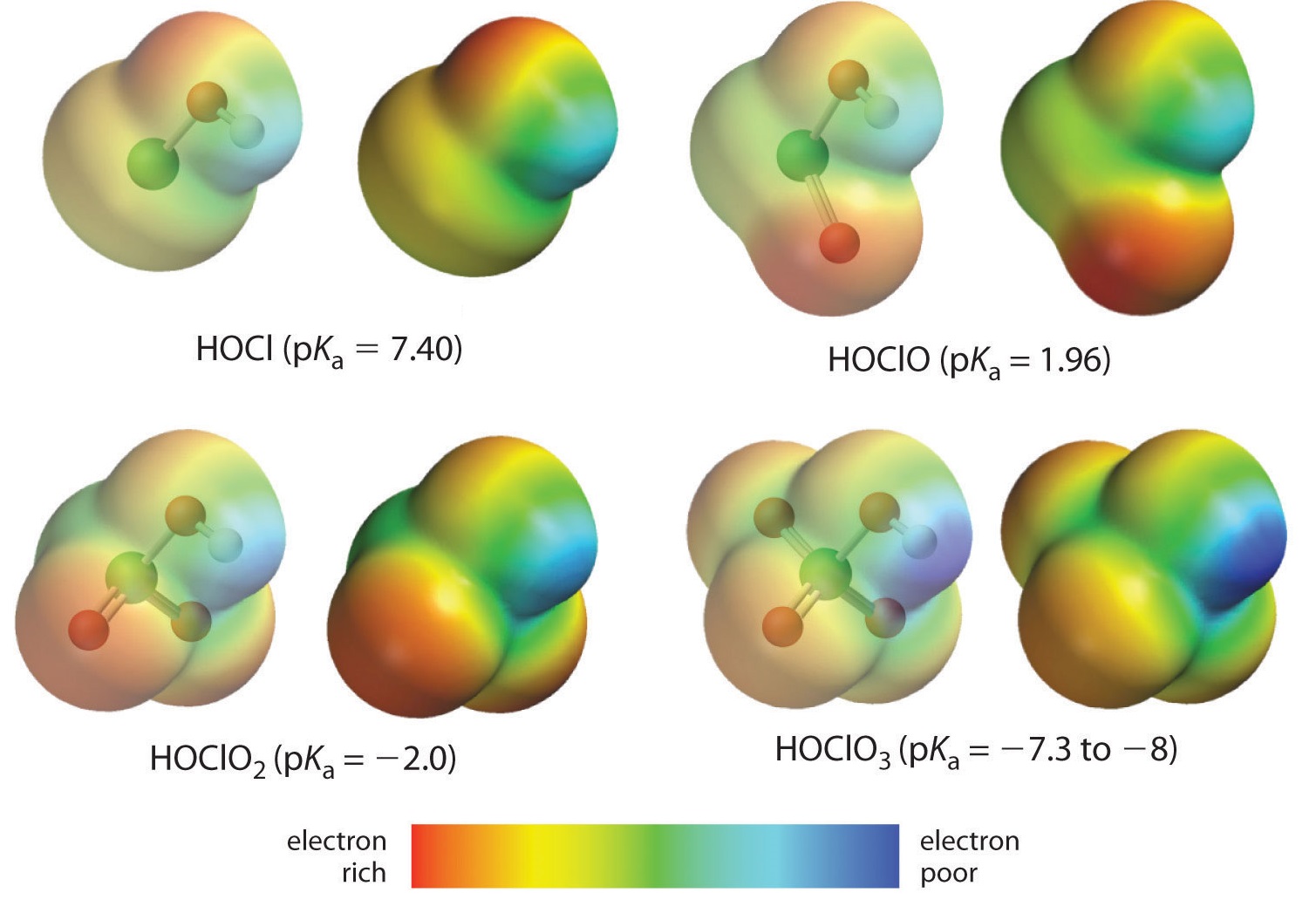
Tady sledujeme trend pro kyseliny, ve kterých je na daný centrální atom vázán různý počet kyslíků. Příkladem je řada kyselin perchlorových (\(\ce{ClO_4^{-}}\), chlorových (\(\ce{ClO_3^{-}}\), chlorových (\(\ce{ClO_2^{-}}\) a hypochlorových (\(\ce{ClO^{-}}\). V těchto řadách je kyselina tím silnější, čím větší je počet kyslíků. To lze vysvětlit několika způsoby. Z hlediska samotné kyseliny je klíčovým faktorem opět indukční účinek, který v tomto případě zahrnuje schopnost oxygenů připojených k centrálnímu atomu přitahovat elektronovou hustotu přes vazbu OH. To je patrné z diagramu hustoty náboje pro oxokyseliny chloru znázorněného na obrázku \(\PageIndex{1}\), kde částečný kladný náboj na kyselém vodíku roste s počtem přítomných oxygenasů.
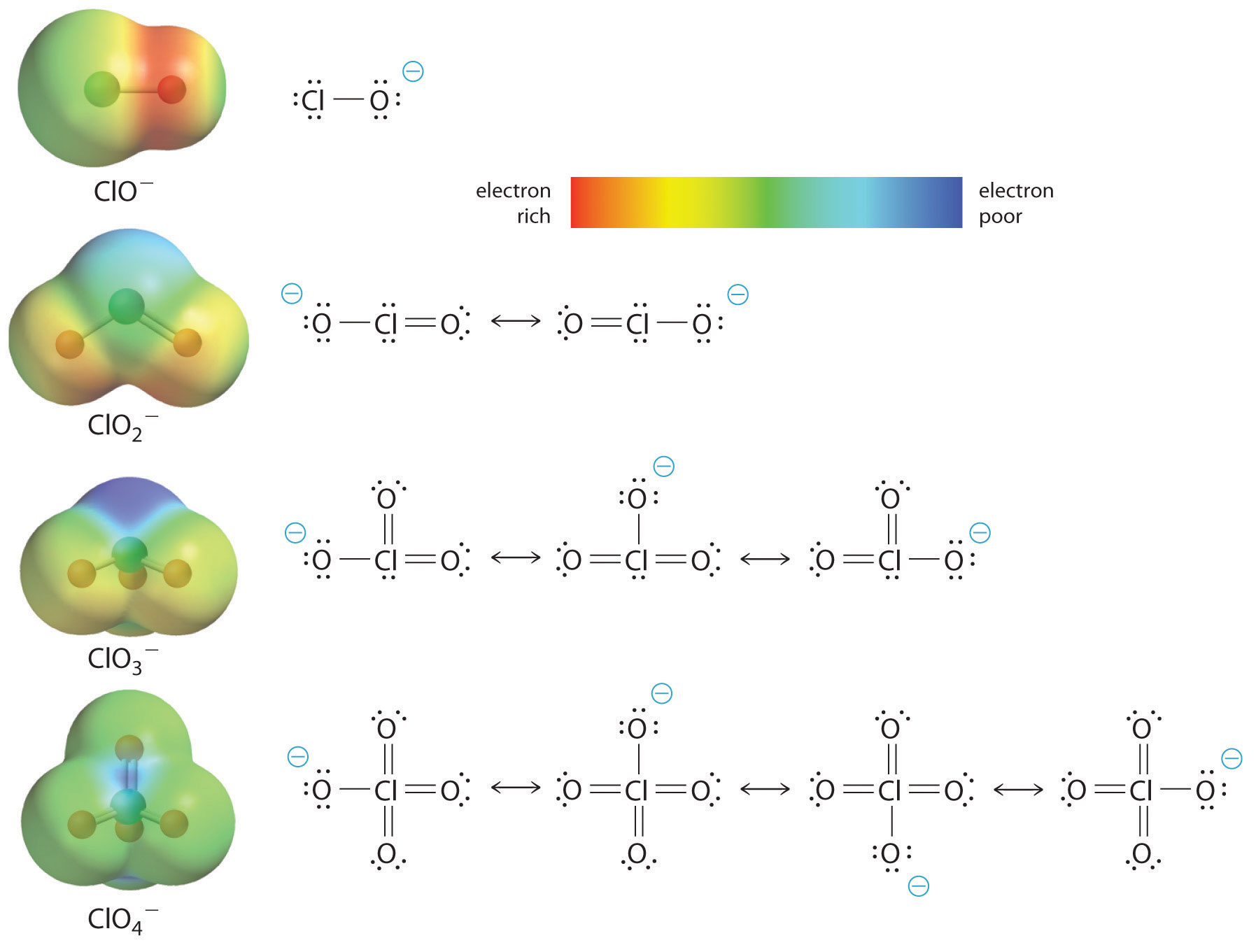
Zvýšení kyselosti oxokyseliny s počtem oxygenasů vázaných na centrální atom lze také pozorovat při zohlednění stability konjugovaného oxyanionu. To, že stabilita konjugované báze roste s počtem oxygenů, lze vyčíst z diagramů rozložení náboje a Lewisových vazebných modelů pro oxyanionty chloru uvedených na obrázku \(\PageIndex{2}\). Jak se záporný náboj rozkládá na více atomů kyslíku, stává se stále více rozptýleným.
Cvičení \(\PageIndex{1}\)
Síra i selen tvoří oxokyseliny vzorce \(\ce{H_2EO_4}\), kde E je buď S, nebo Se. Tyto kyseliny se nazývají kyselina sírová a kyselina selenová. Která oxokyselina by měla být kyselejší: kyselina selenová nebo kyselina sírová?
Odpověď
Kyselina sírová by měla být kyselejší. Protože síra je elektronegativnější než selen, síra bude ve větší míře polarizovat vazby OH, takže budou kyselejší. Tuto předpověď potvrzuje porovnání hodnot \(pK_a\) pro obě kyseliny:
| kyselina | \(pK_{a1}\) | \(pK_{a2}\) |
|---|---|---|
| kyselina sírová, \(H_2SO_3\) | 1.85 | 7,2 |
| kyselina solná, \(H_2SeO_3\) | 2,62 | 8,32 |